ตารางธาตุ (Periodic table of elements) คือ ตารางที่นักวิทยาศาสตร์ได้รวบรวมธาตุต่างๆ ไว้เป็นหมวดหมู่ตามลักษณะ และคุณสมบัติที่เหมือนกัน เพื่อเป็นประโยชน์ในการศึกษาในแต่ละส่วนของตารางธาตุ โดยคาบ ( Period ) เป็นการจัดแถวของธาตุแนวราบ ส่วนหมู่ ( Group ) เป็นการจัดแถวของธาตุในแนวดิ่ง ซึ่งมีรายละเอียดดังต่อไปนี้
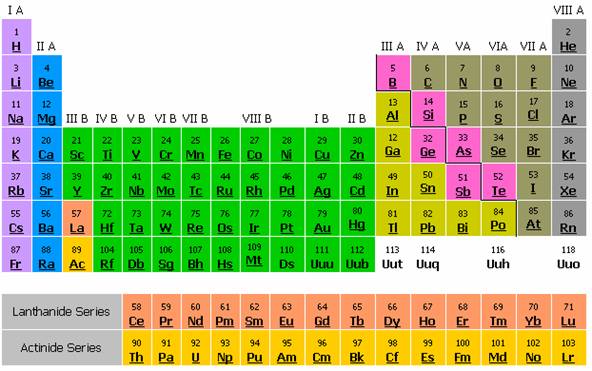
ภาพตารางธาตุปัจจุบัน
- ธาตุหมู่หลัก มีทั้งหมด 8 หมู่ 7 คาบ โดยธาตุที่อยู่ด้านซ้ายของเส้นขั้นบันได จะเป็นโลหะ (Metal) ส่วนทางด้านขวาเป็นอโลหะ (Non metal) ส่วนธาตุที่อยู่ติดกับเส้นขั้นบันไดนั้น จะเป็นกึ่งโลหะ (Metalloid)
- ธาตุทรานซิชัน มีทั้งหมด 8 หมู่ แต่หมู่ 8 มีทั้งหมด 3 หมู่ย่อย จึงมีธาตุต่างๆ รวม 10 หมู่ และมีทั้งหมด 4 คาบ
ธาตุอินเนอร์ทรานซิชัน มี 2คาบโดยมีชื่อเฉพาะเรียกคาบแรกว่าคาบแลนทาไนด์ - (Lanthanide series) และเรียกคาบที่สองว่า คาบแอกทิไนด์ (Actinide series) เพราะเป็นคาบที่อยู่ต่อมาจาก 57La (Lanthanum) และ 89Ac (Actinium) ตามลำดับ คาบละ 14 ตัวรวมเป็น 28 ตัว
การจัดเรียงธาตุลงในตารางธาตุ
เมื่อทราบการจัดเรียงอิเล็กตรอนของธาตุต่างๆ แล้ว จะเห็นว่าสามารถจัดกลุ่มธาตุได้ง่ายขึ้น โดยธาตุที่มีระดับพลังงานเท่ากัน ก็จะถูกจัดอยู่ในคาบเดียวกัน ส่วนธาตุที่มีจำนวนอิเล็กตรอนในระดับพลังงานนอกสุดเท่ากัน ก็จะถูกจัดอยู่ในหมู่เดียวกัน ดังภาพ
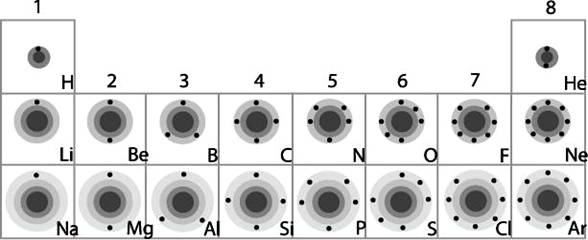
ภาพการจัดเรียงธาตุลงในตารางธาตุ
ประเภทของธาตุในตารางธาตุ
ธาตุโลหะ (metal) โลหะทรานซิชันเป็นต้นฉบับของโลหะ ธาตุโลหะเป็นธาตุที่มีสถานะเป็นของแข็ง ( ยกเว้นปรอท ที่เป็นของเหลว) มีผิวที่มันวาว นำความร้อน และไฟฟ้าได้ดี มีจุดเดือดและจุดหลอมเหลวสูง ( ช่วงอุณหภูมิระหว่างจุดหลอมเหลวกับจุดเดือดจะต่างกันมาก) ได้แก่ โซเดียม (Na) เหล็ก (Fe) แคลเซียม (Ca) ปรอท (Hg) อะลูมิเนียม (Al) แมกนีเซียม (Mg) สังกะสี (Zn) ดีบุก (Sn) เป็นต้น
ธาตุอโลหะ ( Non metal ) มีได้ทั้งสามสถานะ สมบัติส่วนใหญ่จะตรงข้ามกับอโลหะ เช่น ผิวไม่มันวาว ไม่นำไฟฟ้า ไม่นำความร้อน จุดเดือดและจุดหลอมเหลวต่ำ เป็นต้น ได้แก่ คาร์บอน( C ) ฟอสฟอรัส (P) กำมะถัน (S) โบรมีน (Br) ออกซิเจน (O 2) คลอรีน (Cl 2) ฟลูออรีน (F 2) เป็นต้น
ธาตุกึ่งโลหะ (metalloid) เป็นธาตุกึ่งตัวนำ คือ มันจะสามารถนำไฟฟ้าได้เฉพาะในภาวะหนึ่งเท่านั้น ธาตุกึ่งโลหะเหล่านี้จะอยู่บริเวณเส้นขั้นบันได ได้แก่ โบรอน (B) ซิลิคอน ( Si) เป็นต้น
ธาตุกัมมันตรังสี เป็นธาตุที่มีส่วนประกอบของ นิวตรอน กับโปรตอน ไม่เหมาะสม (>1.5) ธาตุที่ 83ขึ้นไปเป็นธาตุกัมมันตภาพรังสีทุกไอโซโทปมีครึ่งชีวิต
สมบัติของธาตุในแต่ละหมู่
ธาตุหมู่ I A หรือโลหะอัลคาไล (alkaline metal)
- โลหะอัลคาไล ได้แก่ ลิเทียม โซเดียม โพแทสเซียม รูบิเดียม ซีเซียม และแฟรนเซียม
- เป็นโลหะอ่อน ใช้มีดตัดได้
- เป็นหมู่โลหะมีความว่องไวต่อการเกิดปฏิกิริยามากที่สุด สามารถทำปฏิกิริยากับออกซิเจนในอากาศ จึงต้องเก็บไว้ในน้ำมัน
-ออกไซด์และไฮดรอกไซด์ของโลหะอัลคาไลละลายน้ำได้สารละลายเบสแก่
- เมื่อเป็นไอออน จะมีประจุบวก
- มีจุดเดือดและจุดหลอมเหลวต่ำ มีความหนาแน่นต่ำเมื่อเทียบกับโลหะอื่นๆ
- มีเวเลนซ์อิเล็กตรอน = 1
- เป็นโลหะอ่อน ใช้มีดตัดได้
- เป็นหมู่โลหะมีความว่องไวต่อการเกิดปฏิกิริยามากที่สุด สามารถทำปฏิกิริยากับออกซิเจนในอากาศ จึงต้องเก็บไว้ในน้ำมัน
-ออกไซด์และไฮดรอกไซด์ของโลหะอัลคาไลละลายน้ำได้สารละลายเบสแก่
- เมื่อเป็นไอออน จะมีประจุบวก
- มีจุดเดือดและจุดหลอมเหลวต่ำ มีความหนาแน่นต่ำเมื่อเทียบกับโลหะอื่นๆ
- มีเวเลนซ์อิเล็กตรอน = 1
ธาตุหมู่ II A หรือโลหะอัลคาไลน์เอิร์ธ (alkaline earth)
- โลหะอัลคาไลน์เอิร์ธ ได้แก่ เบริลเลียม แมกนีเซียม แคลเซียม สตรอนเชียม แบเรียม เรเดียม
- มีความว่องไวต่อการเกิดปฏิกิริยามาก แต่น้อยกว่าโลหะอัลคาไล
- ทำปฏิกิริยากับน้ำได้สารละลายเบส สารประกอบโลหะอัลคาไลน์เอิร์ธพบมากในธรรมชาติ
- โลหะอัลคาไลน์เอิร์ธมีความว่องไวแต่ยังน้อยกว่าโลหะอัลคาไล
- โลหะอัลคาไลน์เอิร์ธมีเวเลนซ์อิเล็กตรอน = 2
- มีความว่องไวต่อการเกิดปฏิกิริยามาก แต่น้อยกว่าโลหะอัลคาไล
- ทำปฏิกิริยากับน้ำได้สารละลายเบส สารประกอบโลหะอัลคาไลน์เอิร์ธพบมากในธรรมชาติ
- โลหะอัลคาไลน์เอิร์ธมีความว่องไวแต่ยังน้อยกว่าโลหะอัลคาไล
- โลหะอัลคาไลน์เอิร์ธมีเวเลนซ์อิเล็กตรอน = 2
ธาตุหมู่ III
- ธาตุหมู่ III ได้แก่ B Al Ga In Tl
- มีเวเลนซ์อิเล็กตรอน = 3
- ธาตุหมู่ III ได้แก่ B Al Ga In Tl
- มีเวเลนซ์อิเล็กตรอน = 3
ธาตุหมู่ IV
- ธาตุหมู่ IV ได้แก่ C Si Ge Sn Pb
- มีเวเลนซ์อิเล็กตรอน = 4
- ธาตุหมู่ IV ได้แก่ C Si Ge Sn Pb
- มีเวเลนซ์อิเล็กตรอน = 4
ธาตุหมู่ V
- ธาตุหมู่ V ได้แก่ N P As Sb Bi
- มีเวเลนซ์อิเล็กตรอน = 5
- ธาตุหมู่ V ได้แก่ N P As Sb Bi
- มีเวเลนซ์อิเล็กตรอน = 5
ธาตุหมู่ VI
- ธาตุหมู่ VI ได้แก่ O S Se Te Po
- มีเวเลนซ์อิเล็กตรอน = 6
- ธาตุหมู่ VI ได้แก่ O S Se Te Po
- มีเวเลนซ์อิเล็กตรอน = 6
ธาตุหมู่ VII หรือหมู่แฮโลเจน (Halogen group)
- หมู่ธาตุแฮโลเจน ได้แก่ ฟลูออรีน คลอรีน โบรมีน ไอโอดีน และแอสทาทีน
- เป็นหมู่อโลหะที่ว่องไวต่อการเกิดปฏิกิริยามากที่สุด (F ว่องไวต่อการเกิดปฏิกิริยามากที่สุด)
- เป็นธาตุที่มีพิษทุกธาตุและมีกลิ่นแรง
- โมเลกุลของธาตุแฮโลเจนประกอบด้วย 2 อะตอม (Cl 2 Br 2 I 2)
- แฮโลเจนไอออนมีประจุบลบหนึ่ง (F - C - Br - I - At -)
- เป็นหมู่อโลหะที่ว่องไวต่อการเกิดปฏิกิริยามากที่สุด (F ว่องไวต่อการเกิดปฏิกิริยามากที่สุด)
- เป็นธาตุที่มีพิษทุกธาตุและมีกลิ่นแรง
- โมเลกุลของธาตุแฮโลเจนประกอบด้วย 2 อะตอม (Cl 2 Br 2 I 2)
- แฮโลเจนไอออนมีประจุบลบหนึ่ง (F - C - Br - I - At -)
ธาตุหมู่ VIII หรือก๊าซเฉื่อย หรือก๊าซมีตระกูล (Inert gas )
- ก๊าซมีตระกูล ได้แก่ ฮีเลียม นีออน อาร์กอน คริปทอน ซีนอน และเรดอน
- มีเวเลนซ์อิเล็กตรอนเต็ม 8 อิเล็กตรอน จึงทำให้เป็นก๊าซที่ไม่ว่องไวต่อการเกิดปฏิกิริยา
- ก๊าซมีตระกูลอยู่เป็นอะตอมเดี่ยว แต่ยกเว้น Kr กับ Xe ที่สามารถสร้างพันธะได้
- มีเวเลนซ์อิเล็กตรอนเต็ม 8 อิเล็กตรอน จึงทำให้เป็นก๊าซที่ไม่ว่องไวต่อการเกิดปฏิกิริยา
- ก๊าซมีตระกูลอยู่เป็นอะตอมเดี่ยว แต่ยกเว้น Kr กับ Xe ที่สามารถสร้างพันธะได้
ขนาดอะตอมของธาตุ
หน่วยพิโกเมตร
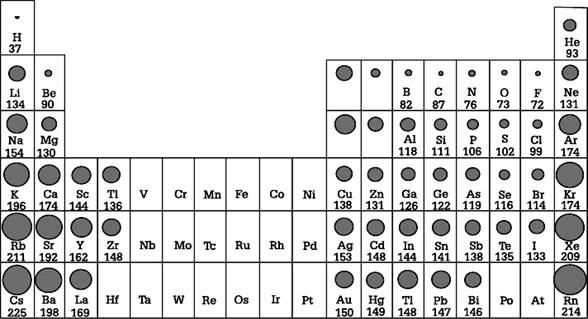

ขนาดอะตอมของธาตุต่างๆ
ขนาดของอะตอมนั้นถ้าจะพิจารณาถึงปัจจัยต่างๆ ที่ส่งผลกระทบต่อขนาดของอะตอมนั้น อาจแบ่งแยกออกได้เป็นข้อ เรียงตามลำดับความสำคัญได้ดังนี้
1. จำนวนระดับพลังงาน
2. จำนวนโปรตอน
3. จำนวนอิเล็กตรอน
ขนาดไอออนของธาตุ
 ............................
............................ 
หน่วยพิโกเมตร
สมบัติอื่นๆ ของธาตุ
พลังงานไอโอไนเซชัน (Ionization Energy : IE) หมายถึง พลังงานปริมาณน้อยที่สุด ที่ทำให้อิเล็กตรอนหลุดจากอะตอม ในสถานะก๊าซ เช่น
ธาตุที่มีอิเล็กตรอนมากกว่า 1 ตัว เช่น ธาตุลิเทียม(Li)
Li(g) Li +(g) + e - IE 1 = 520 kJ/mol
Li +(g) + e - IE 1 = 520 kJ/mol
Li +(g) Li 2+(g) + e - IE 2 = 7,394 kJ/mol
Li 2+(g) + e - IE 2 = 7,394 kJ/mol
Li 2+(g) Li 3+(g) + e - IE 3 = 11,815 kJ/mol
Li 3+(g) + e - IE 3 = 11,815 kJ/mol
Li(g)
Li +(g)
Li 2+(g)
จากการสังเกตจากค่าพลังงานไอออไนเซชันจะพบว่า IE 1 คือพลังงานที่ให้แก่อะตอมเพื่อดึงอิเล็กตรอนที่อยู่วงนอกสุดมีค่าน้อยที่สุด เพราะอิเล็กตรอนที่อยู่ห่างจากนิวเคลียสหลุดออกได้ง่าย
อิเล็กโทรเนกาติวิตี (Electronegativity : EN) หมายถึง ความสามารถในการดึงดูดอิเล็กตรอนในพันธะเข้ามาหาตัวเอง
Na + -------> Cl -
จากภาพจะเห็นว่า อะตอมของ Cl มีความสามารถในการดึงดูดอิเล็กตรอนเข้าหาตัวเองได้ดีกว่า Na แสดงว่า Cl มีค่าอิเล็กโทรเนกาติวิตีสูงกว่า Na
สัมพรรคภาพอิเล็กตรอน ( Electron Affinity : EA ) คือ พลังงานที่อะตอมในสถานะก๊าซคายออกมาเมื่อได้รับอิเล็กตรอน สมการเป็นดังนี้
F(g) + e -  Li -(g) + พลังงาน EA = -333 kJ/mol
Li -(g) + พลังงาน EA = -333 kJ/mol


การแบ่งกลุ่มย่อยตามสมบัติของ 20 ธาตุแรก
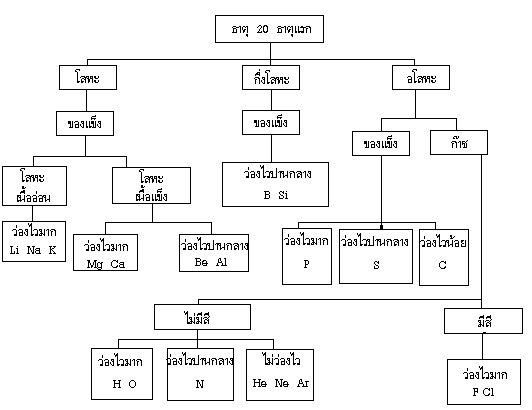
แผนภาพสรุปแนวโน้มสมบัติของธาตุในตารางธาตุ
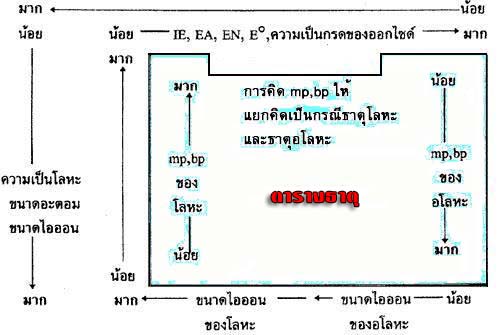
ที่มา: http://nakhamwit.ac.th/pingpong_web/PeriodicTable.htm

ไม่มีความคิดเห็น:
แสดงความคิดเห็น