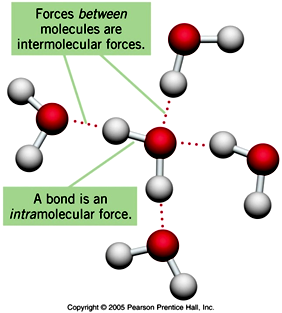
พันธะเคมี คือ แรงยึดเหนี่ยวระหว่างอะตอม หรือไอออนที่มารวมตัวกันเพื่อจัดเวเลนซ์อิเล็กตรอนให้เสถียร
พันธะเคมี แบ่งออกเป็น 2 ประเภท คือ
1. พันธะภายในโมเลกุล ได้แก่
- พันธะไอออนิก
- พันธะโคเวเลนต์
- พันธะโลหะ
2. พันธะระหว่างโมเลกุล ได้แก่
- พันธะไฮโดรเจน
- แรงแวนเดอร์วาลส์
- แรงดึงดูดระหว่างขั้ว
พันธะเคมี แบ่งออกเป็น 2 ประเภท คือ
1. พันธะภายในโมเลกุล ได้แก่
- พันธะไอออนิก
- พันธะโคเวเลนต์
- พันธะโลหะ
2. พันธะระหว่างโมเลกุล ได้แก่
- พันธะไฮโดรเจน
- แรงแวนเดอร์วาลส์
- แรงดึงดูดระหว่างขั้ว
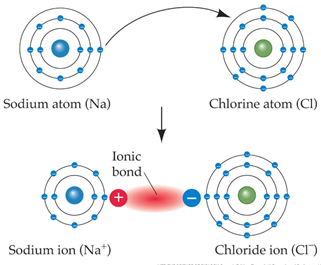
พันธะไอออนิก เป็นพันธะที่เกิดจากแรงกระทำระหว่างอะตอม 2 อะตอมที่มีประจุต่างกัน โดยจะเกิดการแลกเปลี่ยนอิเล็กตรอน ทำให้เกิดแรงดึงดูดทางไฟฟ้าสถิตระหว่างประจุที่ต่างกัน พันธะไอออนิกจะเกิดระหว่างโลหะรวมตัวกับอโลหะ และเกิดขึ้นระหว่างธาตุที่มีค่า EN ต่างกันมาก อะตอมที่มีค่า IE ต่ำ จะให้เวเลนซ์อิเล็กตรอน กลายเป็นไอออนบวก (cation) อะตอมที่มีค่า IE สูง จะรับเวเลนซ์อิเล็กตรอน กลายเป็นไอออนลบ (anion) เรียกสารประกอบที่เกิดพันธะไอออนิกว่า “สารประกอบไอออนิก”
ภาพแสดงการเกิดพันธะไอออนิกของสารประกอบโซเดียมคลอไรด์
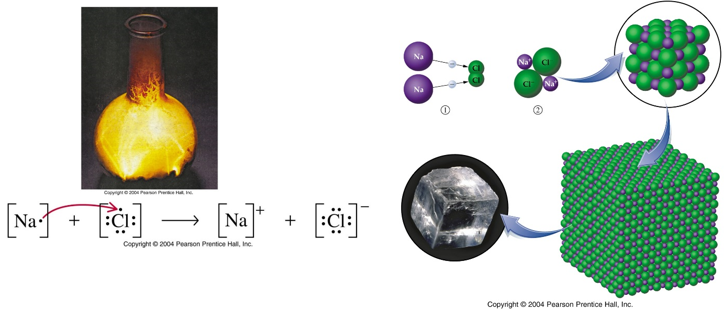
พันธะไอออนิก จะเกิดจากการที่โลหะ (โซเดียม) ให้อิเล็กตรอนแก่อโลหะ (คลอรีน) อะตอมของอโลหะกลายเป็นไอออนลบ (คลอไรด์ไอออน Cl-) อะตอมของโลหะกลายเป็นไอออนบวก (โซเดียมไอออน Na+)
ลักษณะสำคัญของพันธะไอออนิก
1. พันธะไอออนิกเป็นพันธะเคมีที่เกิดจาก ไอออนของโลหะ + ไอออน ของอโลหะ เช่น NaCl, MgO, KI แต่อะตอมของโลหะบางชนิด เช่น Be สามารถสร้างพันธะโคเวเลนต์กับอะตอมของโลหะได้ เช่น BeF2, BeCl2 เป็นต้น
2. พันธะไอออนิก อาจเป็นพันธะเคมีที่เกิดจากธาตุที่มีค่า IE ต่ำรวมกับธาตุที่มี ค่า IE สูง
3. สารประกอบไอออนิกไม่มีสูตรโมเลกุล มีแต่สูตรเอมพิริกัล
4. สารประกอบไอออนิกมีจุดเดือด จุดหลอมเหลวสูง
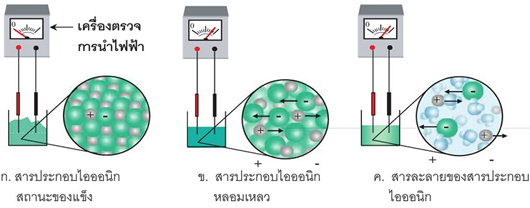
5. สารประกอบไอออนิกในสภาวะปกติเป็นของแข็ง ประกอบด้วย ไอออนบวกและไอออนลบ ไอออนเหล่านี้ไม่เคลื่อนที่ ดังนั้นจึงไม่นำไฟฟ้า แต่เมื่อหลอมเหลวหรือละลายน้ำ จะแตกตัวเป็นไอออนเคลื่อนที่ได้ เกิดเป็นสารอิเล็กโทรไลต์ จึงสามารถนำไฟฟ้าได้
1. พันธะไอออนิกเป็นพันธะเคมีที่เกิดจาก ไอออนของโลหะ + ไอออน ของอโลหะ เช่น NaCl, MgO, KI แต่อะตอมของโลหะบางชนิด เช่น Be สามารถสร้างพันธะโคเวเลนต์กับอะตอมของโลหะได้ เช่น BeF2, BeCl2 เป็นต้น
2. พันธะไอออนิก อาจเป็นพันธะเคมีที่เกิดจากธาตุที่มีค่า IE ต่ำรวมกับธาตุที่มี ค่า IE สูง
3. สารประกอบไอออนิกไม่มีสูตรโมเลกุล มีแต่สูตรเอมพิริกัล
4. สารประกอบไอออนิกมีจุดเดือด จุดหลอมเหลวสูง
5. สารประกอบไอออนิกในสภาวะปกติเป็นของแข็ง ประกอบด้วย ไอออนบวกและไอออนลบ ไอออนเหล่านี้ไม่เคลื่อนที่ ดังนั้นจึงไม่นำไฟฟ้า แต่เมื่อหลอมเหลวหรือละลายน้ำ จะแตกตัวเป็นไอออนเคลื่อนที่ได้ เกิดเป็นสารอิเล็กโทรไลต์ จึงสามารถนำไฟฟ้าได้
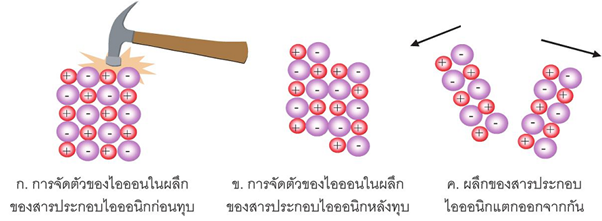
6. เมื่อทุบผลึกของสารไอออนิก จะเกิดการเลื่อนไถลของไอออนไปตามระนาบผลึก เป็นผลให้ไอออนชนิดเดียวกันเลื่อนไปอยู่ตรงกัน จึงเกิดแรงผลักระหว่างไอออน ทำให้ผลึกแตกออก
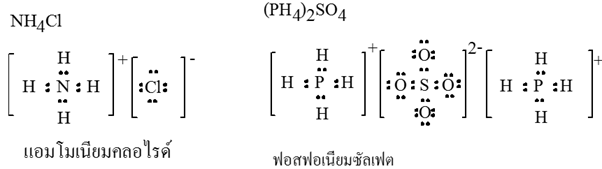
7. พันธะไอออนิก อาจเป็นพันธะเคมีที่เกิดจากไอออนบวกที่เป็นกลุ่มอะตอมของอโลหะ กับไอออนลบของอโลหะ เช่น
การเขียนสูตรและอ่านชื่อสารประกอบไอออนิก
หลักการเขียนสูตรของสารประกอบไอออนิก มีดังนี้
1. เขียนไอออนบวก หรือกลุ่มไอออนบวกไว้ข้างหน้า ตามด้วยไอออนลบหรือกลุ่มไอออนลบ ยกเว้น สารประกอบแอซิเตต (CH3COO–) จะเขียนกลุ่มไอออนลบไว้ก่อนแล้วตามด้วยไอออนบวก เช่น CH3COONa, (CH3COO)2Ca
2. ไอออนบวกและไอออนลบ จะรวมกันในอัตราส่วนที่ทำให้ผลรวมของประจุเป็นศูนย์ ดังนั้นทำได้โดยใช้จำนวนประจุบนไอออนบวก และไอออนลบคูณ ไขว้กัน
3. ถ้ากลุ่มไอออนบวกหรือกลุ่มไอออนลบมีมากกว่า 1 กลุ่ม ให้ใส่วงเล็บ ( ) และใส่จำนวนกลุ่มไว้ที่มุมล่างขวา
หลักการเขียนสูตรของสารประกอบไอออนิก มีดังนี้
1. เขียนไอออนบวก หรือกลุ่มไอออนบวกไว้ข้างหน้า ตามด้วยไอออนลบหรือกลุ่มไอออนลบ ยกเว้น สารประกอบแอซิเตต (CH3COO–) จะเขียนกลุ่มไอออนลบไว้ก่อนแล้วตามด้วยไอออนบวก เช่น CH3COONa, (CH3COO)2Ca
2. ไอออนบวกและไอออนลบ จะรวมกันในอัตราส่วนที่ทำให้ผลรวมของประจุเป็นศูนย์ ดังนั้นทำได้โดยใช้จำนวนประจุบนไอออนบวก และไอออนลบคูณ ไขว้กัน
3. ถ้ากลุ่มไอออนบวกหรือกลุ่มไอออนลบมีมากกว่า 1 กลุ่ม ให้ใส่วงเล็บ ( ) และใส่จำนวนกลุ่มไว้ที่มุมล่างขวา
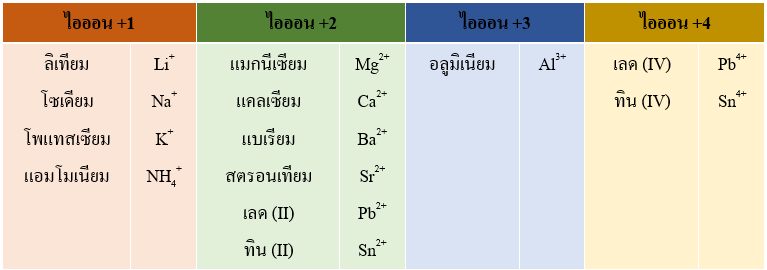
ไอออนบวกของธาตุกลุ่ม A
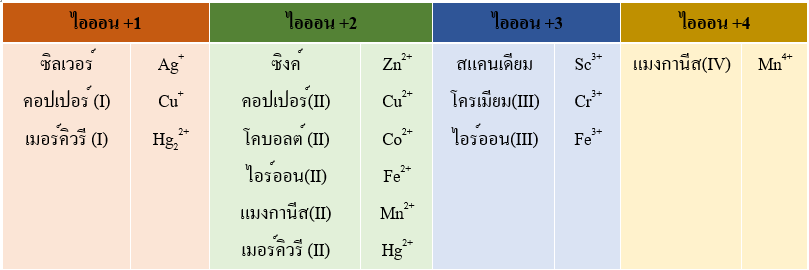
ไอออนบวกของธาตุกลุ่ม B
ไอออนลบ
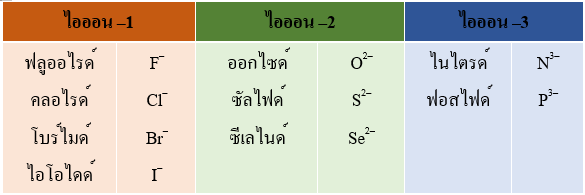
กลุ่มไอออนลบ

ตัวอย่างการเขียนสูตรและอ่านชื่อ สารประกอบไอออนิก 
ประเภทที่ 1 ; ไอออนบวก รวมกับ ไอออนลบ
Ex. 1 ; Na + Cl
Ex. 2 ; Na + S
Ex. 3 ; Al + O
ประเภทที่ 1 ; ไอออนบวก รวมกับ ไอออนลบ
Ex. 1 ; Na + Cl
Ex. 2 ; Na + S
Ex. 3 ; Al + O
ประเภทที่ 2 ; ไอออนบวก รวมกับ กลุ่มไอออนลบ
Ex. 1 ; Li + CN
Ex. 2 ; Ca + PO4
Ex. 3 ; Al + SO4
Ex. 1 ; Li + CN
Ex. 2 ; Ca + PO4
Ex. 3 ; Al + SO4
ประเภทที่ 3 ; ไอออนบวกแทรนสิชัน รวมกับ ไอออนลบ หรือกลุ่มไอออนลบ
Ex. 1 ; Cr6+ + O
Ex. 2 ; Cu2+ + NO3
Ex. 3 ; Ti4+ + SO4
Ex. 1 ; Cr6+ + O
Ex. 2 ; Cu2+ + NO3
Ex. 3 ; Ti4+ + SO4
พลังงานกับการเกิดสารประกอบไอออนิก
ในการเกิดสารประกอบไอออนิก จะมีการเปลี่ยนแปลงหลายขั้นตอนย่อย ๆ และแต่ละขั้นตอนย่อยจะมีการเปลี่ยนแปลงพลังงาน เช่น
การเกิดโซเดียมคลอไรด์จากโลหะ Na กับก๊าซ Cl2
ในการเกิดสารประกอบไอออนิก จะมีการเปลี่ยนแปลงหลายขั้นตอนย่อย ๆ และแต่ละขั้นตอนย่อยจะมีการเปลี่ยนแปลงพลังงาน เช่น
การเกิดโซเดียมคลอไรด์จากโลหะ Na กับก๊าซ Cl2

แสดงว่าการเกิด NaCl เป็นการเปลี่ยนแปลงแบบคายพลังงาน
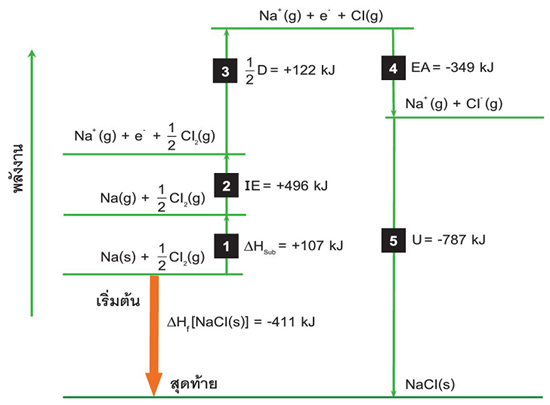
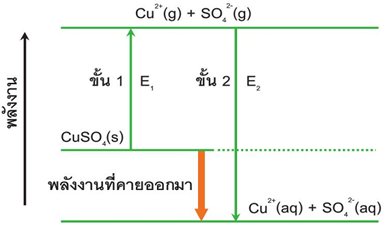
เขียนแผนภาพ แสดงขั้นตอนการเปลี่ยนแปลงพลังงานต่าง ๆ ในการเกิดสารประกอบไอออนิกได้ดังนี้
เขียนแผนภาพ แสดงขั้นตอนการเปลี่ยนแปลงพลังงานต่าง ๆ ในการเกิดสารประกอบไอออนิกได้ดังนี้
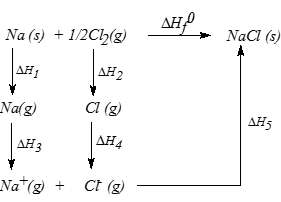
เรียกแผนภาพดังกล่าวว่า Born - Haber cycle
ในการเกิดสารประกอบไอออนิกจากโลหะและอโลหะนั้น จะมีพลังงานเกี่ยวข้อง 2 แบบ คือ ขั้นที่ 1 , 2 , 3 เป็นแบบดูดพลังงาน ส่วนขั้นตอนที่ 4 และ 5 เป็นแบบคายพลังงาน ดังนั้น
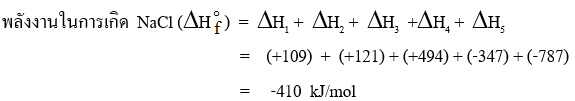
ในการเกิดสารประกอบไอออนิกจากโลหะและอโลหะนั้น จะมีพลังงานเกี่ยวข้อง 2 แบบ คือ ขั้นที่ 1 , 2 , 3 เป็นแบบดูดพลังงาน ส่วนขั้นตอนที่ 4 และ 5 เป็นแบบคายพลังงาน ดังนั้น
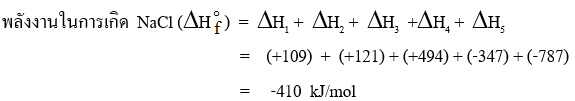
ตัวอย่าง การเกิด NaCl มีพลังงาน 5 ขั้นตอน ดังนี้
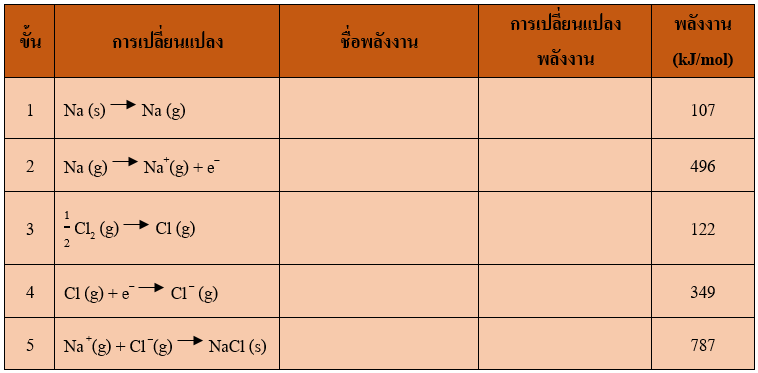
The Born–Haber Cycle for the formation for 1 mole of solid NaCl (s).
ตัวอย่าง จงเขียนปฏิกิริยาที่เกี่ยวข้องกับพลังงานในการเกิดสารประกอบไอออนิกจากธาตุที่กำหนดให้ต่อไปนี้
1) โพแทสเซียมกับฟลูออรีน
2) แมกนีเซียมกับคลอรีน
1) โพแทสเซียมกับฟลูออรีน
2) แมกนีเซียมกับคลอรีน
พลังงานกับการละลายสารประกอบไอออนิก
ประกอบด้วย 2 ขั้นตอน คือ
ขั้นที่ 1 ผลึกสารประกอบไอออนิกดูดพลังงาน และแตกตัวเป็นไอออนในสภาวะก๊าซ เรียกพลังงานนี้ว่า พลังงานแลตทิซ (Lattice energy)
ประกอบด้วย 2 ขั้นตอน คือ
ขั้นที่ 1 ผลึกสารประกอบไอออนิกดูดพลังงาน และแตกตัวเป็นไอออนในสภาวะก๊าซ เรียกพลังงานนี้ว่า พลังงานแลตทิซ (Lattice energy)
ขั้นที่ 2 ไอออน ที่เป็นก๊าซจะถูกน้ำล้อมรอบ มีการคายพลังงานออกมา เรียกพลังงานนี้ว่า พลังงานไฮเดรชัน (Hydration energy)
ที่เป็นก๊าซจะถูกน้ำล้อมรอบ มีการคายพลังงานออกมา เรียกพลังงานนี้ว่า พลังงานไฮเดรชัน (Hydration energy)
ตัวอย่าง การละลายน้ำของ NaCl ประกอบด้วย 2 ขั้นตอน คือ
ขั้นที่ 1 ผลึกสารประกอบไอออนิกแตกตัวเป็นไอออนในสภาวะก๊าซ ซึ่งมีการดูดพลังงานเพื่อสลายพันธะไอออนิกระหว่าง Na+ กับ Cl- ออกจากกันเป็นไอออนในสภาวะก๊าซ พลังงานนี้มีค่าเท่ากับ พลังงานแลตทิซ (Lattice energy) ใช้สัญลักษณ์ย่อว่า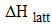
ขั้นที่ 1 ผลึกสารประกอบไอออนิกแตกตัวเป็นไอออนในสภาวะก๊าซ ซึ่งมีการดูดพลังงานเพื่อสลายพันธะไอออนิกระหว่าง Na+ กับ Cl- ออกจากกันเป็นไอออนในสภาวะก๊าซ พลังงานนี้มีค่าเท่ากับ พลังงานแลตทิซ (Lattice energy) ใช้สัญลักษณ์ย่อว่า
ขั้นที่ 2 ไอออนที่เป็นก๊าซจะถูกน้ำล้อมรอบเกิดไฮเดรตมีการคายพลังงานออกมา เรียกพลังงานนี้ว่า พลังงานไฮเดรชัน ( Hydration energy) ใช้สัญลักษณ์ย่อว่า 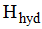
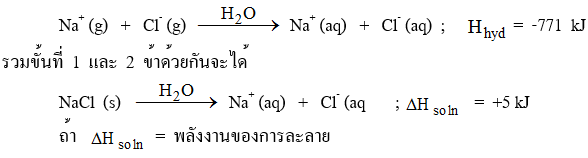
ภาพแสดงการละลายน้ำของ NaCl
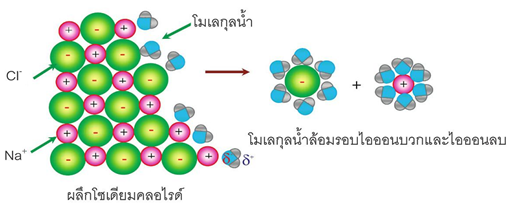
ภาพแสดงขั้นตอนการละลายน้ำของของ CuSO4
การละลายน้ำของสารประกอบไอออนิก
ความสามารถในการละลายของสาร คือ ความสามารถของสารที่ละลายในตัวทำละลายจนอิ่มตัวแต่ความสามารถในการละลายของสารประกอบไอออนิกจะมากแค่ไหนขึ้นอยู่กับอุณหภูมิและชนิดของสาร สำหรับการบอกความสามารถในการละลายโดยมากมักจะบอกได้ ดังนี้
ความสามารถในการละลายของสาร คือ ความสามารถของสารที่ละลายในตัวทำละลายจนอิ่มตัวแต่ความสามารถในการละลายของสารประกอบไอออนิกจะมากแค่ไหนขึ้นอยู่กับอุณหภูมิและชนิดของสาร สำหรับการบอกความสามารถในการละลายโดยมากมักจะบอกได้ ดังนี้
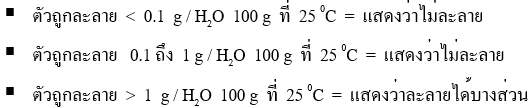
สารประกอบไอออนิกที่ละลายน้ำได้ ได้แก่
1. สารประกอบของโลหะหมู่ IA
2. สารประกอบแอมโมเนียม
3. สารประกอบไนเตรต
4. สารประกอบคลอเรต
5. สารประกอบเปอร์คลอเรต
6. สารประกอบแอซิเตต (ยกเว้น CH3COOAg)
7. สารประกอบซัลเฟต (ยกเว้น PbSO4, CaSO4, SrSO4, BaSO4)
1. สารประกอบของโลหะหมู่ IA
2. สารประกอบแอมโมเนียม
3. สารประกอบไนเตรต
4. สารประกอบคลอเรต
5. สารประกอบเปอร์คลอเรต
6. สารประกอบแอซิเตต (ยกเว้น CH3COOAg)
7. สารประกอบซัลเฟต (ยกเว้น PbSO4, CaSO4, SrSO4, BaSO4)
สารประกอบไอออนิกที่ไม่ละลายน้ำ ได้แก่
1. สารประกอบออกไซด์ ซัลไฟด์ และไฮดรอกไซด์ของโลหะ (ยกเว้น โลหะหมู่ IA และ Ca2+, Sr2+, Ba2+)
2. สารประกอบคลอไรด์, โบรไมด์ และไอโอไดด์ของ Ag+, Pb2+, Hg22+
3. สารประกอบคาร์บอเนต, ฟอสเฟต และซัลไฟต์ของธาตุหมู่ IIA
สมการไอออนิก
สมการไอออนิก คือ สมการที่แสดงไอออนอิสระของสารประกอบไอออนิกในสารละลายครบ ทุกชนิด
สมการไอออนิกสุทธิ คือ สมการที่แสดงเฉพาะไอออนที่เข้าทำปฏิกิริยากันแล้วเกิดเป็นผลิตภัณฑ์
หลักการเขียนสมการไอออนิก
1. ให้เขียนเฉพาะส่วนไอออนหรือโมเลกุลของสารทำปฏิกิริยากันเท่านั้น
2. ถ้าสารที่เกี่ยวข้องในปฏิกิริยาเป็นสารที่ไม่ละลายน้ำหรือไม่แตกตัวเป็นไอออนหรือเป็นออกไซด์หรือเป็นก๊าซให้เขียนสูตรโมเลกุลของสารนั้นในสมการได้ ตัวอย่าง ออกไซด์ เช่น CO2 , H2O ก๊าซ เช่น H2 , NH3 สารที่ไม่ละลายน้ำ เช่น CaCO3 , AgCl
3. ดุลสมการไอออนิกโดยทำจำนวนอะตอมและจำนวนไอออนของธาตุทุกธาตุทั้งทางซ้ายและทางขวาของสมการให้เท่ากัน พร้อมทั้งดุลประจุรวมทั้งทางซ้ายและ ขวาของสมการให้เท่ากัน
1. สารประกอบออกไซด์ ซัลไฟด์ และไฮดรอกไซด์ของโลหะ (ยกเว้น โลหะหมู่ IA และ Ca2+, Sr2+, Ba2+)
2. สารประกอบคลอไรด์, โบรไมด์ และไอโอไดด์ของ Ag+, Pb2+, Hg22+
3. สารประกอบคาร์บอเนต, ฟอสเฟต และซัลไฟต์ของธาตุหมู่ IIA
สมการไอออนิก
สมการไอออนิก คือ สมการที่แสดงไอออนอิสระของสารประกอบไอออนิกในสารละลายครบ ทุกชนิด
สมการไอออนิกสุทธิ คือ สมการที่แสดงเฉพาะไอออนที่เข้าทำปฏิกิริยากันแล้วเกิดเป็นผลิตภัณฑ์
หลักการเขียนสมการไอออนิก
1. ให้เขียนเฉพาะส่วนไอออนหรือโมเลกุลของสารทำปฏิกิริยากันเท่านั้น
2. ถ้าสารที่เกี่ยวข้องในปฏิกิริยาเป็นสารที่ไม่ละลายน้ำหรือไม่แตกตัวเป็นไอออนหรือเป็นออกไซด์หรือเป็นก๊าซให้เขียนสูตรโมเลกุลของสารนั้นในสมการได้ ตัวอย่าง ออกไซด์ เช่น CO2 , H2O ก๊าซ เช่น H2 , NH3 สารที่ไม่ละลายน้ำ เช่น CaCO3 , AgCl
3. ดุลสมการไอออนิกโดยทำจำนวนอะตอมและจำนวนไอออนของธาตุทุกธาตุทั้งทางซ้ายและทางขวาของสมการให้เท่ากัน พร้อมทั้งดุลประจุรวมทั้งทางซ้ายและ ขวาของสมการให้เท่ากัน

ไม่มีความคิดเห็น:
แสดงความคิดเห็น