การเกิดพันธะโคเวลเนต์
พันธะโคเวเลนต์(Covalent bond) มาจากคำว่า co + valence electron ซึ่งหมายถึง พันธะที่เกิดจากการใช้เวเลนซ์อิเล็กตรอนร่วมกัน ดังเช่น ในกรณีของไฮโดรเจน ดังนั้นลักษณะที่สำคัญของ พันธะโคเวเลนต์ก็คือการที่อะตอมใช้เวเลนต์อิเล็กตรอนร่วมกันเป็นคู่ ๆ
-สารประกอบที่อะตอมแต่ละคู่ยึดเหนี่ยวกันด้วยพันธะโคเวเลนต์ เรียกว่าสารโคเวเลนต์
-โมเลกุลของสารที่อะตอมแต่ละคู่ยึดเหนี่ยวกันด้วยพันธะโคเวเลนต์เรียกว่าโมเลกุลโคเวเลนต์
1. การเกิดพันธะโคเวเลนต์
เนื่องจาก พันธะโคเวเลนต์ เกิดจากการใช้เวเลนต์อิเล็กตรอนร่วมกัน ซึ่งอาจจะใช้ร่วมกันเพียง 1 คู่ หรือมากกว่า 1 คู่ก็ได้
- อิเล็กตรอนคู่ที่อะตอมทั้งสองใช้ร่วมกันเรียกว่า “อิเล็กตรอนคู่ร่วมพันธะ”
- อะตอมที่ใช้อิเล็กตรอนร่วมกันเรียกว่าอะตอมคู่ร่วมพันธะ
* ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 1 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่าพันธะเดี่ยวเช่น ในโมเลกุลของไฮโดรเจน
* ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 2 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่าพันธะคู่เช่น ในโมเลกุลของออกซิเจน
* ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 3 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่าพันธะสามเช่น ในโมเลกุลของไฮโดรเจน
จากการศึกษาสารโคเวเลนต์จะพบว่า ธาตุที่จะสร้างพันธะโคเวเลนต์ส่วนมากเป็นธาตุอโลหะกับอโลหะ ทั้งนี้เนื่องจากโลหะมีพลังงานไอออไนเซชันค่อนข้างสูง จึงเสียอิเล็กตรอนได้ยาก เมื่ออโลหะรวมกันเป็นโมเลกุลจึงไม่มีอะตอมใดเสียอิเล็กตรอน มีแต่ใช้อิเล็กตรอนร่วมกันเกิดเป็นพันธะโคเวเลนต์ อย่างไรก็ตามโลหะบางชนิดก็สามารถเกิดพันธะโคเวเลนต์กับอโลหะได้ เช่น Be เกิดเป็นสารโคเวเลนต์คือ BeCl2เป็นต้น
ชนิดของพันธะโคเวเลนต์

ชนิดของพันธะโคเวเลนต์
พิจารณาจากจำนวนอิเล็กตรอนที่ใช้ร่วมกันของอะตอมคู่ร่วมพันธะ ดังนี้
ก. พันธะเดี่ยวเป็นพันธะโคเวเลนต์ที่เกิดจากอะตอมคู่สร้างพันธะทั้งสองใช้อิเล็กตรอนร่วมกัน 1 คู่ ใช้เส้น ( - ) แทนพันธะเดี่ยว เช่น

ข. พันธะคู่เป็นพันธะโคเวเลนต์ที่เกิดจากอะตอมคู่สร้างพันธะทั้งสองใช้อิเล็กตรอนร่วมกัน 2 คู่ ใช้เส้น 2 เส้น ( = ) แทน 1 พันธะคู่ เช่นพันธะระหว่าง O ใน O2, O กับ C ใน CO2, C กับ H ใน C2H4

3 การเขียนสูตรและการเรียกชื่อสารประกอบโคเวเลนต์
การเขียนสูตรสารประกอบโคเวเลนต์เรียงตามหลักสากล ดังนี้
Si C Sb As P N H Te S At I Br Cl O F
2. จากความรู้เรื่องกฎออกเตต ทำให้สามารถทำนายสูตรอย่างง่ายของสารได้ โดยใช้ความต้องการอิเล็กตรอนคู่ร่วมพันธะของแต่ละอะตอมของธาตุคูณไขว้ เช่น
ตัวอย่างที่1สูตรของสารประกอบของธาตุ H กับ S ; H และ S มีเวเลนต์อิเล็กตรอน 1 และ 6 ตามลำดับ ดังนั้น H และ S ต้องการอิเล็กตรอนคู่ร่วมพันธะจำนวน 1 และ 2 ตามลำดับ เพื่อให้แต่ละอะตอมของธาตุมีการจัดอิเล็กตรอนแบบก๊าซเฉื่อย
ตัวอย่างที่ 2 สูตรของสารประกอบของธาตุ S กับ C ; S และ C มีเวเลนต์อิเล็กตรอน 6 และ 4 ตามลำดับ ดังนั้น S และ C ต้องการอิเล็กตรอนคู่ร่วมพันธะจำนวน 2 และ 4 ตามลำดับ เพื่อให้แต่ละอะตอมของธาตุมีการจัดอิเล็กตรอนแบบก๊าซเฉื่อย
ตัวอย่างที่ 3 สูตรของสารประกอบของธาตุ N กับ Cl ; N และ Cl มีเวเลนต์อิเล็กตรอน 5 และ 7 ตามลำดับ ดังนั้น N และ Cl ต้องการอิเล็กตรอนคู่ร่วมพันธะจำนวน 3 และ 1 ตามลำดับ เพื่อให้แต่ละอะตอมของธาตุมีการจัดอิเล็กตรอนแบบก๊าซเฉื่อย
ตัวอย่างที่1สูตรของสารประกอบของธาตุ H กับ S ; H และ S มีเวเลนต์อิเล็กตรอน 1 และ 6 ตามลำดับ ดังนั้น H และ S ต้องการอิเล็กตรอนคู่ร่วมพันธะจำนวน 1 และ 2 ตามลำดับ เพื่อให้แต่ละอะตอมของธาตุมีการจัดอิเล็กตรอนแบบก๊าซเฉื่อย
ตัวอย่างที่ 2 สูตรของสารประกอบของธาตุ S กับ C ; S และ C มีเวเลนต์อิเล็กตรอน 6 และ 4 ตามลำดับ ดังนั้น S และ C ต้องการอิเล็กตรอนคู่ร่วมพันธะจำนวน 2 และ 4 ตามลำดับ เพื่อให้แต่ละอะตอมของธาตุมีการจัดอิเล็กตรอนแบบก๊าซเฉื่อย
ตัวอย่างที่ 3 สูตรของสารประกอบของธาตุ N กับ Cl ; N และ Cl มีเวเลนต์อิเล็กตรอน 5 และ 7 ตามลำดับ ดังนั้น N และ Cl ต้องการอิเล็กตรอนคู่ร่วมพันธะจำนวน 3 และ 1 ตามลำดับ เพื่อให้แต่ละอะตอมของธาตุมีการจัดอิเล็กตรอนแบบก๊าซเฉื่อย
การเรียกชื่อสารประกอบโคเวเลนต์(Names of Covalent Compounds)
1.อ่านชื่อธาตุที่อยู่ด้านหน้าก่อนตามด้วยธาตุที่อยู่ด้านหลังโดยเปลี่ยนเสียงพยางค์ท้ายเป็นไ-ด์(ide )2
2.อ่านระบุจำนวนอะตอมของธาตุด้วยเลขจำนวนในภาษากรีก ได้แก่
1 =mono-2=di-3=tri-4=tetra-5=penta-6=hexa-7=octa-8=nona-9=deca-
3 .ถ้าธาตุแรกมีอะตอมเดียว ไม่ต้องอ่านระบุจำนวนอะตอมของธาตุนั้นแต่ถ้าธาตุหลังมีเพียงหนึ่งอะตอมก็ต้องระบุจำนวนอะตอมด้วยเสมอ
ตัวอย่างการอ่านชื่อ
CO2อ่านว่าคาร์บอนไดออกไซด์,COอ่านว่าคาร์บอนมอนออกไซด์,
BF3อ่านว่าโบรอนไตรฟลูออไรด์,N2Oอ่านว่าไดไนโตรเจนมอนอกไซด์,
N2O5อ่านว่าไดไนโตรเจนเพนตอกไซด์, P4O10อ่านว่าเตตระฟอสฟอรัสเดคะออกไซด์
OF2อ่านว่าออกซิเจนไดฟลูออไรด์, CCl4อ่านว่าคาร์บอนเตตระคลอไรด์
BF3อ่านว่าโบรอนไตรฟลูออไรด์,N2Oอ่านว่าไดไนโตรเจนมอนอกไซด์,
N2O5อ่านว่าไดไนโตรเจนเพนตอกไซด์, P4O10อ่านว่าเตตระฟอสฟอรัสเดคะออกไซด์
OF2อ่านว่าออกซิเจนไดฟลูออไรด์, CCl4อ่านว่าคาร์บอนเตตระคลอไรด์
4 กฏออกเตต
กฎออกเตต (Octet rule)
จากการศึกษาธาตุเฉื่อย เช่น He, Ne,Ar,Kr พบว่าเป็นธาตุที่จัดอยู่ในประเภทโมเลกุลอะตอมเดียวทุกสถานะ คือใน 1 โมเลกุลของธาตุเฉื่อยจะมีเพียง 1 อะตอมทั้งสถานะของแข็ง ของเหลว และก๊าซในธรรมชาติเกือบจะไม่พบสารประกอบของธาตุเฉื่อยเลย แสดงว่าธาตุเฉื่อยเป็นธาตุที่เสถียรมาก เกิดปฏิกิริยาเคมีกับธาตุอื่นได้ยาก ทำให้นักวิทยาศาสตร์สนใจค้นคว้าถึงเหตุผลที่ทำให้ธาตุเฉื่อยมีความเสถียร จากการศึกษาโครงสร้างอะตอมของธาตุเฉื่อยพบว่าธาตุเฉื่อยมีการจัดเรียงอิเล็กตรอนวงนอกสุดเหมือนกัน คือ มี 8 เวเลนต์อิเล็กตรอน (ยกเว้นธาตุ He มี 2 ) เช่น
2He = 2
10Ne = 2 , 8
18Ar = 2 , 8 , 8
36Kr= 2 , 8 , 18 , 8
เมื่อเปรียบเทียบกับโครงสร้างอะตอมของธาตุอื่น ๆ เช่น H , O , N
1H = 1
8O = 2 , 6
7N = 2 , 5
ธาตุเหล่านี้มีเวเลนต์อิเล็กตรอนน้อยกว่า 8 ในธรรมชาติจะไม่สามารถอยู่เป็นอะตอมเดี่ยว ได้ ซึ่งไม่เสถียร ต้องรวมกันเป็นโมเลกุลซึ่งอาจจะมี 2 อะตอมหรือมากกว่า การที่ธาตุเฉื่อยมี 8 เวเลนต์อิเล็กตรอนแล้วทำให้เสถียรกว่าธาตุอื่นๆ ซึ่งมีเวเลนต์อิเล็กตรอนไม่เท่ากับ 8 ทำให้นัก วิทยาศาสตร์เชื่อว่าโครงสร้างของอะตอมที่มี 8 เวเลนต์อิเล็กตรอนเป็นสภาพที่อะตอมเสถียรที่สุด ดังนั้นธาตุต่าง ๆ ที่มีเวเลนต์อิเล็กตรอนน้อยกว่า 8 จึงพยายามปรับตัวให้มีโครงสร้างแบบธาตุเฉื่อย เช่น โดยการรวมตัวกันเป็นโมเลกุลหรือใช้อิเล็กตรอนร่วมกันเพื่อทำให้เวเลนต์อิเล็กตรอนเท่ากับ 8 ส่วนไฮโดรเจนจะพยายามปรับตัวให้มีเวเลนต์อิเล็กตรอนเท่ากับ 2 เหมือนธาตุ He
การที่อะตอมของธาตุต่าง ๆ รวมตัวกันด้วยสัดส่วนที่ทำให้มีเวเลนต์อิเล็กตรอนเท่ากับ 8 นี้ นักวิทยาศาสตร์ได้ตั้งเป็นกฎเรียกว่ากฎออกเตต
ดังนั้นธาตุต่าง ๆ จึงพยายามรวมตัวกัน เพื่อให้เป็นไปตามกฎออกเตต ซึ่งจะทำให้ได้สารประกอบหรือโมเลกุลที่อยู่ในสภาพที่เสถียร สำหรับการรวมตัวกันด้วยพันธะโคเวเลนต์จะมีการใช้เวเลนต์อิเล็กตรอนร่วมกันระหว่างอะตอมคู่ร่วมพันธะ อิเล็กตรอนที่ใช้ร่วมกันถือว่าเป็นอิเล็กตรอนของอะตอมคู่ร่วมพันธะทั้งสอง
เช่น F2 มีสูตรแบบจุดเป็น

อะตอมของ F มีเวเลนต์อิเล็กตรอนเท่ากับ 7
เมื่อเกิดพันธะโคเวเลนต์มีการใช้อิเล็กตรอนร่วมกัน 1 คู่ ซึ่งอิเล็กตรอนที่ใช้ร่วมกัน 1 คู่นี้ถือว่าเป็นของฟลูออรีนทั้ง 2 อะตอม ทำให้ฟลูออรีนแต่ละอะตอมใน F2มีเวเลนต์อิเล็กตรอนเท่ากับ 8
จำนวนเวเลนต์อิเล็กตรอนของธาตุแต่ละชนิดอาจจะแสดงให้เห็นได้ชัดเจนขึ้นโดยการเขียนวงกลมล้อมรอบแต่ละอะตอม จำนวนอิเล็กตรอนที่อยู่ในวงกลมของธาตุใดก็จัดว่าเป็นของธาตุนั้น เช่น

ดังที่ได้กล่าวมาแล้วว่าอะตอมของธาตุต่าง ๆ มักจะรวมตัวกันเป็นสารประกอบเพื่อให้เป็นไปตามกฎออกเตต ซึ่งจะทำให้สารประกอบนั้นอยู่ในสภาพที่เสถียร เช่น H2O, PCl3, NH3, CO2อย่างไรก็ตาม เมื่อมีการศึกษาให้กว้างขวางออกไปก็พบว่าสารประกอบบางชนิดมีการจัดเรียงอิเล็กตรอนไม่เป็นไปตามกฎออกเตต บางชนิดมีเวเลนต์อิเล็กตรอนน้อยกว่า 8 และบางชนิดมี เวเลนต์อิเล็กตรอนมากกว่า 8 ซึ่งสารต่าง ๆ เหล่านี้แม้ว่าจะไม่เป็นไปตามกฎออกเตต แต่ก็อยู่ในภาวะที่ไม่เสถึยร จัดว่าเป็นข้อยกเว้นสำหรับกฎออกเตต ซึ่งสรุปได้ดังนี้
ก. พวกที่ไม่ครบออกเตต
ได้แก่สารประกอบของธาตุในคาบที่ 2 ของตารางธาตุ ที่มีเวเลนต์อิเล็กตรอนน้อยกว่า 4 เช่น4Be และ5B
4Be = 2 , 2 เวเลนต์อิเล็กตรอนเท่ากับ 2
5B = 2 , 3 เวเลนต์อิเล็กตรอนเท่ากับ 3
ธาตุ Be และ B เมื่อเกิดเป็นสารประกอบโคเวเลนต์ทั่ว ๆ ไปจะไม่ครบออกเตต
ตัวอย่างเช่น BF3, BCl3, BeCl2และ BeF2เป็นต้น
* ใน BF3ธาตุ B จะมีเวเลนต์อิเล็กตรอนเท่ากับ 6 ซึ่งไม่ครบออกเตต ในขณะที่ธาตุ F ครบออกเตต
* ใน BeCl2ธาตุ Be จะมีเวเลนต์อิเล็กตรอนเท่ากับ 4 ซึ่งไม่ครบออกเตต ในขณะที่ธาตุ Cl ครบออกเตต
แต่ถ้าธาตุเหล่านี้เกิดเป็นสารประกอบเชิงซ้อน บางชนิดจะเป็นไปตามกฎออกเตต เช่น BF4-, BCl3.NH3
- ใน BF4-ทั้ง B และ F ต่างก็มีเวเลนต์อิเล็กตรอนเท่ากับ 8 เป็นไปตามกฎออกเตต
- ใน BCl3.NH3ทั้ง B , Cl , N และ F ต่างก็เป็นไปตามกฎออกเตต
ข. พวกที่เกินกฎออกเตต
ตามทฤษฎีสารประกอบของธาตุที่อยู่ในคาบที่ 3 ของตารางธาตุเป็นต้นไป สารมารถสร้างพันธะแล้วทำให้อิเล็กตรอนเกิน 8 ได้ (ตามกฎการจัดอิเล็กตรอน 2n2ในคาบที่ 3 สามารถมีอิเล็กตรอนได้เต็มที่ถึง 18 อิเล็กตรอน) แต่อย่างไรก็ตามพวกที่เกินออกเตตมักจะพบในสารประกอบบางตัวของ P , S และโลหะทรานซิชัน เช่นใน PCl5, SF6, Fe(CN)63-, Co(NH3)62+, SiF62-และ Icl3เป็นต้น
- ใน PCl5ธาตุ P เกิดพันธะกับ Cl รวม 5 พันธะจึงมีเวเลนต์อิเล็กตรอนเท่ากับ 10 ซึ่งเกินออกเตต ( 1 พันธะหรือ 1 เส้นประกอบด้วย 2 อิเล็กตรอน) สำหรับ PCl3หรือสารประกอบอื่น ๆ ของธาตุ P ส่วนมากเป็นไปตามกฎออกเตต
- ใน SF6ธาตุ S เกิดพันธะกับ F รวม 6 พันธะจึงมีเวเลนต์อิเล็กตรอนเท่ากับ 12 ซึ่งเกินออกเตต แต่ใน SF2หรือสารประกอบอื่น ๆ ของธาตุ S ส่วนมากเป็นไปตามกฎออกเตต
- ใน ICl3ธาตุ I เกิดพันธะกับ Cl รวม 3 พันธะและมีอิเล็กตรอนคู่โดดเดี่ยว 2 คู่ จึงรวมเป็น 10 อิเล็กตรอน ซึ่งเกินออกเตต แต่ ICl หรือสารประกอบอื่น ๆ ของ I ส่วนใหญ่เป็นไปตามกฎออกเตต
- ใน Co(NH3)62+ธาตุ Co เกิดพันธะกับ N ใน NH3รวม 6 พันธะจึงมีเวเลนต์อิเล็กตรอนเท่ากับ 12 ซึ่งเกินออกเตต
นอกจากสารประกอบที่ไม่เป็นไปตามกฎออกเตตดังที่ได้กล่าวมาแล้ว ยังมีสารประกอบอื่น ๆ อีกบางชนิดซึ่งไม่เป็นไปตามกฎออกเตต เช่น ออกไซด์บางตัวของธาตุไนโตรเจน ( NO และ NO2)และออกไซด์ของคลอรีน (ClO2) เป็นต้น ธาตุเหล่านี้ (N และ Cl) สามารถมีอิเล็กตรอนที่ไม่ได้จับคู่ หรืออิเล็กตรอนเดี่ยว (Unpaired electron) ซึ่งทำให้แสดงสมบัติเป็น paramagnetic ได้
- ใน NO ธาตุ N มีเพียง 7 อิเล็กตรอนซึ่งไม่เป็นไปตามกฎออกเตต
- ใน NO2ธาตุ N เกิดพันธะกับธาตุ O แต่มีอิเล็กตรอนเพียง 7 ซึ่งไม่ครบออกเตต
- ใน ClO2ธาตุ Cl เกิดพันธะกับธาตุ O แต่มีอิเล็กตรอนเพียง 7 ซึ่งไม่ครบออกเตต
- 5 พลังงานพันธะพลังงานพันธะ (Bond energy) คือพลังงานที่ใช้ในการสลายพันธะระหว่างอะตอมของธาตุภายในโมเลกุลที่อยู่ในสถานะก๊าซออกเป็นอะตอมเดี่ยว เช่นH2(g) + 436 kJ ----------------> 2H (g)จากสมการก๊าซ H21 โมลต้องการจะสลายเป็น H อะตอม 2 โมล ต้องใช้พลังงาน 436 kJHI (g) + 298 kJ----------> H (g) + I (g)ก๊าซ HI 1 โมลต้องการสลายเป็น H และ I อะตอมอย่างละ 1โมลต้องใช้พลังงาน 298 kJจากตัวอย่างข้างต้นนี้แสดงว่าสารต่างชนิดกัน จำนวนโมลเท่ากัน พลังงานที่ใช้สลายพันธะก็ต่างกัน การสลายพันธะชนิดเดียวกันในสารต่างชนิดกันจะใช้พลังงานสลายไม่เท่ากัน เช่น การสลายพันธะ C - H ใน CH4และ C2H6มีค่าไม่เท่ากันCH4(g) + 435 kJ -------------> CH3(g) + H (g)C2H6(g) + 400 kJ ------------> C2H5(g) + H (g)แลการสลายพันธะชนิดเดียวกันในสารเดียวกัน (ที่มีพันธะชนิดเดียวกัน) ก็ใช้พลังงานสลายไม่เท่ากัน เช่น การสลายพันธะ C - H ใน CH4CH4(g) + 435 kJ------------> CH3(g) + H (g)CH3(g) + 464 kJ ------------> CH2(g) + H (g)CH2(g) + 422 kJ -------------> CH (g) + H (g)CH(g) + 339 kJ --------------> C (g) + H (g)เมื่อรวมขั้นทั้ง 4 เข้าด้วยกันจะได้ว่าCH4(g) + 1660 kJ --------------> C (g) + 4H (g)พลังงานที่ทำให้โมเลกุล CH4แตกออกเป็นอะตอมในสภาวะก๊าซ เรียกว่า Atomization energy และพลังงานเฉลี่ยของพันธะ C - H ใน CH4= 1660/4 = 415 kJ เรียกพลังงานค่านี้ว่าพลังงานพันธะเฉลี่ย( Average bond energy )อนึ่งจากตารางที่ 6.1 ค่าพลังงานเฉลี่ยของพันธะ C - H ของสารทั่ว ๆ ไป มีค่า 413 kJ ซึ่งมีค่าต่างจากค่าพลังงานเฉลี่ยของพันธะ C - H ซึ่งหาได้จาก CH4เท่านั้นเนื่องจากพลังงานที่ใช้สลายพันธะแต่ละพันธะในคู่อะตอมเดียวกันไม่เท่ากัน จึงเป็นการยากที่จะจดจำและไม่สะดวกต่อการใช้ ดังนั้นเพื่อความสะดวกจึงนิยมใช้พลังงานพันธะเฉลี่ยแทน ดังในตารางที่ 2ตารางที่35 พลังงานพันธะเฉลี่ยระหว่างอะตอมคู่ต่าง ๆพลังงานพันธะ (kJ/mol)หมู่ 4 Aหมู่ 5 Aหมู่ 6 Aหมู่ 7 AC - H 413C - C 348C - N 305C - F 485C - Cl 339C - Br 285C - I 240C - S 272Si - H 323Si - Si 226Si - C 301Si - O 368C = C 614C C 839C = N 615N - H 391N - N 163N - O 201N - F 272N - Cl 200N - Br 243N = N 418N N 945O - H 463O - O 146O - F 190O - Cl 203O - I 234S - H 367S - F 327S - Cl 253S - S 255O = O 498S = O 523S = S 418H - H 436H - F 567H - Cl 431H - Br 366H - I 298F - F 159Cl - F 253Cl - Cl 242Br - F 237Br - Cl 218Br - Br 193I - Cl 208I - Br 175I - I 151ลักษณะสำคัญของพันธะเคมี1. พลังงานพันธะมีหน่วยเป็น กิโลจูล/โมล (kJ/mol) หรือกิโลแคลอรี่/โมล (kcal/mol)2. พลังงานที่ใช้ในการสลายพันธะจำนวน 1 โมล หรือพลังงานที่ได้จากการเกิดพันธะจำนวน 1 โมล เรียกว่า พลังงานพันธะ3. พันธะชนิดเดียวกัน พลังงานที่ใช้สลายพันธะและพลังงานที่ได้จากการเกิดพันธะจำนวนเท่ากัน มีค่าเท่ากันเสมอ แต่ถ้าสลายพันธะต่างชนิดกันจะใช้พลังงานต่างกัน4. พลังงานพันธะบอกให้ทราบถึงความแข็งแรงของพันธะ คือ พันธะเคมีที่ต้องใช้พลังงานสลายสูงกว่า จะมีความแข็งแรงของพันธะมากกว่าพันธะเคมีที่ต้องใช้พลังงานสลายต่ำกว่า นั่นคือ พันธะระหว่างอะตอมคู่เดียวกัน ความแข็งแรงของพันธะเดี่ยว < พันธะคู่ < พันธะสาม5. ปฏิกิริยาเคมีใด ๆ ที่เกิดขึ้น โดยทั่วไปจะมีการสลายพันธะเดิม และการเกิดพันธะใหม่ พลังงานที่เปลี่ยนแปลงไปในปฏิกิริยา จะเท่ากับผลต่างระหว่างพลังงานที่ระบบดูดเข้าไปสลายพันธะเดิมทั้งหมดกับพลังงานที่ระบบคายออกมาเมื่อเกิดพันธะใหม่ทั้งหมดH = (พลังงานที่ระบบดูด) - (พลังงานที่ระบบคาย)
- ถ้าระบบดูดพลังงาน > คายพลังงาน
พลังงานที่เปลี่ยนแปลง (H ) = (ดูด - คาย )จะได้ค่าH มีเครื่องหมายเป็นบวกแสดงว่าระบบมีการเปลี่ยนแปลงเป็นแบบดูดพลังงาน- ถ้าระบบดูดพลังงาน < คายพลังงาน
พลังงานที่เปลี่ยนแปลง (H ) = (ดูด - คาย )จะได้ค่าH มีเครื่องหมายเป็นลบแสดงว่าระบบมีการเปลี่ยนแปลงเป็นแบบคายพลังงาน6. ในปฏิกิริยาเคมีใด ๆ ที่มีแต่การสลายพันธะ ไม่มีการเกิดพันธะใหม่ เป็นปฏิกิริยาดูดพลังงาน (Endothermic Reaction) เช่นO2(g) + 498 kJ --------------> 2O (g)หรือ O2(g) -------------> 2O (g) ; H = +498 kJCH4(g) + 1660 kJ -------------> C (g) + 4 H (g)หรือ CH4(g) ------------> C (g) + 4 H (g) ; H = +1660 kJ7. ในปฏิกิริยาเคมีใด ๆ ที่มีแต่การเกิดพันธะใหม่ ไม่มีการสลายพันธะ จะเป็นปฏิกิริยาคายพลังงาน (Exothermic Reaction) เช่นO (g) + 2H (g) ---------> H2O (g) + 926 kJหรือ O (g) + 2H (g) -----------> H2O (g) ; H = - 926 kJCl (g) + Cl (g) ----------> Cl2(g) + 242 kJหรือ Cl (g) + Cl (g) ------------> Cl2(g) ; H = - 242 kJ8. ในปฏิกิริยาเคมีใด ๆ ที่มีทั้งการสลายพันธะและการเกิดพันธะใหม่ ปฏิกิริยานั้นอาจจะเป็นการเปลี่ยนแปลงประเภทดูดหรือคายพลังงานก็ได้ ทั้งนี้ขึ้นอยู่กับพลังงานที่ใช้ในการสลายพันธะ กับพลังงานที่เกิดจากการสร้างพันธะใหม่เป็นเกณฑ์- ปฏิกิริยาที่มีพลังงานที่ใช้สลายพันธะทั้งหมด มากกว่าพลังงานที่ได้จากการเกิดพันธะใหม่ทั้งหมด เรียก ปฏิกิริยานั้นว่า ปฏิกิริยาดูดพลังงาน เช่น
2NH3(g) + 92 kJ -------------> N2(g) + 3H2(g)หรือ 2NH3(g) ----------------> N2(g) + 3H2(g) - 92 kJหรือ 2NH3(g) -----------------> N2(g) + 3H2(g) ; H = + 92 kJ- ปฏิกิริยาที่มีพลังงานที่ใช้สลายพันธะทั้งหมด น้อยกว่าพลังงานที่ได้จากการเกิดพันธะใหม่ทั้งหมดเรียกปฏิกิริยานั้นว่า ปฏิกิริยาคายพลังงาน เช่น
H2(g) + F2(g) -----------------> 2HF (g) + 539 kJหรือ H2(g) + F2(g) -539 kJ -----------> 2HF (g)หรือ H2(g) + F2(g) ---------> 2HF (g) ; H = -539 kJ9. สำหรับปฏิกิริยาเคมีที่มีทั้งการสลายพันธะและการเกิดพันธะใหม่ แต่ไม่ทราบพลังงานพันธะก็อาจจะคาดคะเนได้ว่าเป็นปฏิกิริยาประเภทดูดหรือคายพลังงานได้ โดยใช้จำนวนพันธะที่สลายและจำนวนพันธะที่เกิดขึ้นใหม่เป็นเกณฑ์ คือ ถ้าจำนวนพันธะที่สลายทั้งหมดของสารตั้งต้น มากกว่าจำนวนพันธะที่เกิดใหม่ของสารผลิตภัณฑ์ทั้งหมดก็เป็นประเภทดูดความร้อน ถ้าน้อยกว่า ก็เป็นประเภทคายพลังงาน หรือพิจารณาได้จากลักษณะของปฏิกิริยา คือ ถ้าเป็นการสลายโมเลกุลใหญ่ออกเป็นโมเลกุลเล็ก ๆ ส่วนมากเป็นปฏิกิริยาดูดพลังงาน แต่ถ้าเป็นการรวมโมเลกุลเล็ก ๆ เกิดเป็นโมเลกุลใหญ่ หรือเป็นปฏิกิริยาการเผาไหม้ ส่วนมากเป็นปฏิกิริยาคายความร้อน เช่น2NH3(g) + 92 kJ --------------> N2(g) + 3H2(g) ดูดพลังงานC2H4(g) ------------> C2H2(g) + H2( g) ดูดพลังงานH2(g) + I2(g) -------------> 2HI (g) คายพลังงาน2C2H2(g) + 5O2(g) ------------------> 4CO2(g) + 2H2O (g) คายพลังงานการคำนวณพลังงานกับปฏิกิริยาเคมีตัวอย่างที่1จงคำนวณพลังงานความร้อนในการเกิด HCl จากปฏิกิริยาH2(g)+ Cl2(g)-------------> 2HCl(g)กำหนดพลังงานพันธะ*D(H - H) = 436 kJ/molD(Cl - Cl) = 242 kJ/molD(H - Cl) = 431 kJ/molวิธีทำพันธะที่สลาย มี (H - H) 1 โมล(Cl - Cl) 1 โมลพลังงานที่ใช้สลายพันธะทั้งหมด = D(H - H) + D(Cl - Cl)= 436 + 242 kJ = 678 kJพันธะที่เกิดมี ( H - Cl ) 2 โมลพลังงานที่เกิดจากการสร้างพันธะทั้งหมด = 2 D(H - Cl)= 2 (431) kJ = 862 kJพลังงานความร้อนของปฏิกิริยา = (678) - (862) = -184 kJพลังงานในการเกิดสารใหม่คิดเป็นค่าพลังงานต่อโมลของสารใหม่ที่เกิดHCl 2 โมล พลังงานความร้อน = -184 kJHCl 1 โมล พลังงานความร้อน = -184 x kJพลังงานในการเกิด HCl = -92 kJซึ่งเป็นปฏิกิริยาคายความร้อน - 6 โครงสร้างโมเลกุลโคเวเลนต์ (1)โครงสร้างของโมเลกุลโคเวเลนต์จากการศึกษาสมบัติและโครงสร้างของสารต่าง ๆ จะพบว่าสารที่มีโครงสร้างต่างกันจะมีสมบัติต่างกัน ถึงแม้ว่าจะมีสูตรโมเลกุลเหมือนกันหรือไม่ก็ตาม เช่น เอทานอล และเมทานอล และเมทอกซีมีเทน ซึ่งมีสูตรโมเลกุลเป็น C2H6เหมือนกัน แต่มีสูตรโครงสร้างต่างกันจึงทำให้สารทั้งสองมีสมบัติต่างกันด้วย
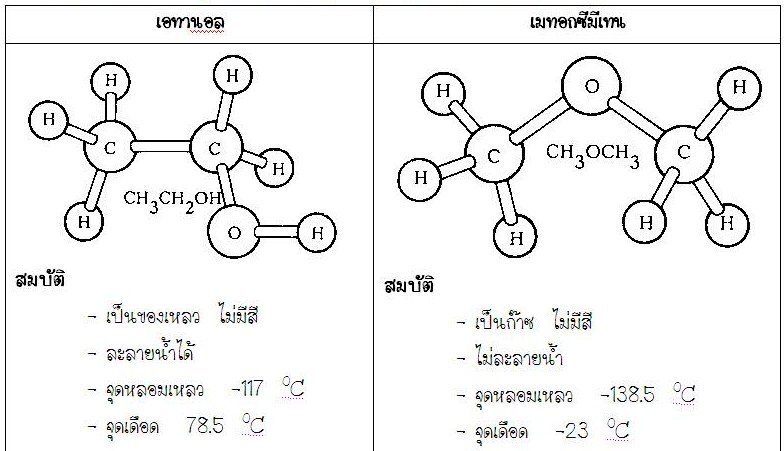 จากตัวอย่างทั้งสองนี้แสดงให้เห็นว่า โครงสร้างโมเลกุล (รูปร่างโมเลกุล) มีความสัมพันธ์กับสมบัติของสาร ดังนั้นในการศึกษาสมบัติของสารจึงจำเป็นต้องทราบโครงสร้างโมเลกุลหรือรูปร่างโมเลกุลของสารนั้นด้วยรูปร่างโมเลกุลโคเวลนต์การจัดเรียงอะตอมต่าง ๆ ในโมเลกุลโคเวเลนต์มีตำแหน่งและทิศทางที่แน่นอนจึงทำให้โมเลกุลโคเวเลนต์ของสารต่าง ๆ มีรูปร่างแตกต่างกัน สิ่งที่ใช้บอกรูปร่างโมเลกุลโคเวเลนต์จะเป็นอย่างไรนั้น คือ การจัดเวเลนต์อิเล็กตรอนรอบอะตอมกลางของธาตุในโมเลกุลโคเวเลนต์ นอกจากนั้นความยาวพันธะและมุมระหว่างพันธะยังสามารถใช้บอกรูปร่างโมเลกุลได้ด้วยความยาวพันธะ(Bond length)คือ ระยะทางระหว่างนิวเคลียสของอะตอมคู่หนึ่งที่มีพันธะต่อกันมุมระหว่างพันธะ(Bond angle)คือ มุมที่เกิดจากอะตอมสองอะตอมทำกับอะตอมกลางหรือมุมที่เกิดระหว่างพันธะสองพันธะ เช่น
จากตัวอย่างทั้งสองนี้แสดงให้เห็นว่า โครงสร้างโมเลกุล (รูปร่างโมเลกุล) มีความสัมพันธ์กับสมบัติของสาร ดังนั้นในการศึกษาสมบัติของสารจึงจำเป็นต้องทราบโครงสร้างโมเลกุลหรือรูปร่างโมเลกุลของสารนั้นด้วยรูปร่างโมเลกุลโคเวลนต์การจัดเรียงอะตอมต่าง ๆ ในโมเลกุลโคเวเลนต์มีตำแหน่งและทิศทางที่แน่นอนจึงทำให้โมเลกุลโคเวเลนต์ของสารต่าง ๆ มีรูปร่างแตกต่างกัน สิ่งที่ใช้บอกรูปร่างโมเลกุลโคเวเลนต์จะเป็นอย่างไรนั้น คือ การจัดเวเลนต์อิเล็กตรอนรอบอะตอมกลางของธาตุในโมเลกุลโคเวเลนต์ นอกจากนั้นความยาวพันธะและมุมระหว่างพันธะยังสามารถใช้บอกรูปร่างโมเลกุลได้ด้วยความยาวพันธะ(Bond length)คือ ระยะทางระหว่างนิวเคลียสของอะตอมคู่หนึ่งที่มีพันธะต่อกันมุมระหว่างพันธะ(Bond angle)คือ มุมที่เกิดจากอะตอมสองอะตอมทำกับอะตอมกลางหรือมุมที่เกิดระหว่างพันธะสองพันธะ เช่น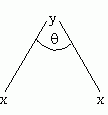 มุม เป็นมุมระหว่างพันธะในโมเลกุล yx2และมุมระหว่างพันธะจะกว้างหรือแคบขึ้นอยู่กับแรงผลักระหว่างอิเล็กตรอนคู่โดดเดี่ยวและอิเล็กตรอนคู่ร่วมพันธะรอบ ๆ อะตอมกลาง โดยถือหลักว่าโมเลกุลที่เสถียรจะต้องมีพลังงานต่ำ นั่นคือ อะตอมในโมเลกุลต้องจัดเรียงตัวกันเพื่อให้มแรงผลักของคู่อิเล็กตรอนให้น้อยที่สุดการทำนายรูปร่างโมเลกุลโคเวเลนต์โมเลกุลโคเวเลนต์จะมีรูปร่างเป็นอย่างไร พิจารณาจาก1. จำนวนอิเล็กตรอนคู่ร่วมพันธะรอบอะตอมกลาง (bonding electron)2. จำนวนอิเล็กตรอนคู่โดดเดี่ยวรอบอะตอมกลาง (non bonding electron)ดังนั้นการทำนายรูปร่างโมเลกุลให้เลือกอะตอมกลาง ซึ่งเป็นอะตอมที่สร้างพันธะได้มากที่สุดก่อน และนับจำนวนพันธะที่อะตอมกลางสร้างได้ และจำนวนอิเล็กตรอนคู่โดดเดี่ยวรอบอะตอมกลางนั้น แรงผลักทั้งหมดของคู่อิเล็กตรอนที่เกิดจากการสร้างพันธะ และไม่ได้สร้างพันธะจะทำให้เกิดรูปร่างโมเลกุลที่แตกต่างกันดังนี้1. รูปร่างเส้นตรง ( Linear)โมเลกุล BeCl2มีสูตรโครงสร้างแบบจุดและแบบเส้นดังนี้อะตอมกลาง Be ในโมเลกุล BeCl2มีเวเลนต์อิเล็กตรอนทั้งหมด 2 คู่ และทั้งสองคู่เป็นอิเล็กตรอนคู่ร่วมพันธะ ซึ่งจะเกิดการผลักกันให้ห่างกันมากที่สุด ทำให้โมเลกุลเป็นรูปร่างเส้นตรง มีมุมระหว่างพันธะเป็น 1800ดังรูป
มุม เป็นมุมระหว่างพันธะในโมเลกุล yx2และมุมระหว่างพันธะจะกว้างหรือแคบขึ้นอยู่กับแรงผลักระหว่างอิเล็กตรอนคู่โดดเดี่ยวและอิเล็กตรอนคู่ร่วมพันธะรอบ ๆ อะตอมกลาง โดยถือหลักว่าโมเลกุลที่เสถียรจะต้องมีพลังงานต่ำ นั่นคือ อะตอมในโมเลกุลต้องจัดเรียงตัวกันเพื่อให้มแรงผลักของคู่อิเล็กตรอนให้น้อยที่สุดการทำนายรูปร่างโมเลกุลโคเวเลนต์โมเลกุลโคเวเลนต์จะมีรูปร่างเป็นอย่างไร พิจารณาจาก1. จำนวนอิเล็กตรอนคู่ร่วมพันธะรอบอะตอมกลาง (bonding electron)2. จำนวนอิเล็กตรอนคู่โดดเดี่ยวรอบอะตอมกลาง (non bonding electron)ดังนั้นการทำนายรูปร่างโมเลกุลให้เลือกอะตอมกลาง ซึ่งเป็นอะตอมที่สร้างพันธะได้มากที่สุดก่อน และนับจำนวนพันธะที่อะตอมกลางสร้างได้ และจำนวนอิเล็กตรอนคู่โดดเดี่ยวรอบอะตอมกลางนั้น แรงผลักทั้งหมดของคู่อิเล็กตรอนที่เกิดจากการสร้างพันธะ และไม่ได้สร้างพันธะจะทำให้เกิดรูปร่างโมเลกุลที่แตกต่างกันดังนี้1. รูปร่างเส้นตรง ( Linear)โมเลกุล BeCl2มีสูตรโครงสร้างแบบจุดและแบบเส้นดังนี้อะตอมกลาง Be ในโมเลกุล BeCl2มีเวเลนต์อิเล็กตรอนทั้งหมด 2 คู่ และทั้งสองคู่เป็นอิเล็กตรอนคู่ร่วมพันธะ ซึ่งจะเกิดการผลักกันให้ห่างกันมากที่สุด ทำให้โมเลกุลเป็นรูปร่างเส้นตรง มีมุมระหว่างพันธะเป็น 1800ดังรูป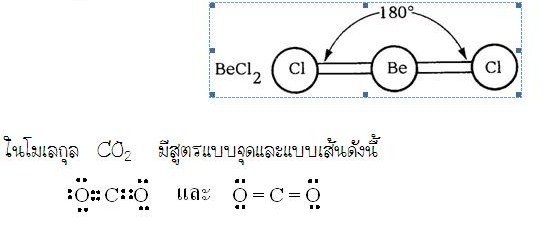 2. รูปร่างสามเหลี่ยมแบนราบ (Trigonal planar)ในโมเลกุล BCl3มีสูตรแบบจุดและแบบเส้นดังนี้
2. รูปร่างสามเหลี่ยมแบนราบ (Trigonal planar)ในโมเลกุล BCl3มีสูตรแบบจุดและแบบเส้นดังนี้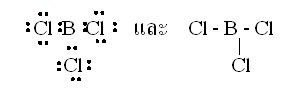 อะตอมกลาง B ในโมเลกุล BCl3มีเวเลนต์อิเล็กตรอนทั้งหมด 3 คู่ และทั้ง 3 คู่เป็นอิเล็กตรอนคู่ร่วมพันธะเดี่ยว 3 พันธะ ซึ่งเกิดการผลักกันให้ห่างกันมากที่สุด ทำให้โมเลกุลเป็นรูปสามเหลี่ยมแบนราบ มีมุมระหว่างพันธะเป็น 1200ดังรูป
อะตอมกลาง B ในโมเลกุล BCl3มีเวเลนต์อิเล็กตรอนทั้งหมด 3 คู่ และทั้ง 3 คู่เป็นอิเล็กตรอนคู่ร่วมพันธะเดี่ยว 3 พันธะ ซึ่งเกิดการผลักกันให้ห่างกันมากที่สุด ทำให้โมเลกุลเป็นรูปสามเหลี่ยมแบนราบ มีมุมระหว่างพันธะเป็น 1200ดังรูป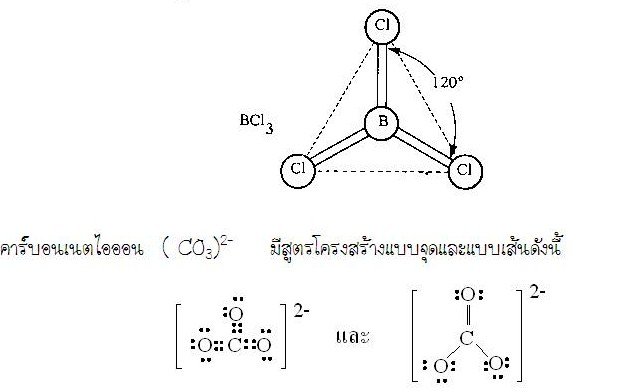
- 7. มุมระหว่างพันธะมุมระหว่างพันธะของโมเลกุลโคเวเลนต์มุมระหว่างพันธะของโมเลกุลโคเวเลนต์ โดยทั่วไปขึ้นอยู่กับจำนวนอิเล็กตรอนคู่โดดเดี่ยวรออบอะตอมกลางเป็นเกณฑ์ นอกจากนั้นยังขึ้นอยู่กับรูปร่างโมเลกุล จำนวนพันธะรอบอะตอมกลางในโมเลกุล จำนวนอิเล็กตรอนคู่ร่วมพันธะ และค่าอิเล็กโตรเนกาติวิตีของธาตุหลักการพิจารณามุมระหว่างพันธะของโมเลกุลโคเวเลนต์1. โมเลกุลโคเวเลนต์ใด ๆ ถ้าอะตอมกลางมีอิเล็กตรอนคู่โดดเดี่ยวไม่เท่ากัน โมเลกุลใดอะตอมกลางมีอิเล็กตรอนคู่โดดเดี่ยวมาก จะผลักกันมากทำให้มุมระหว่างพันธะแคบ เช่น
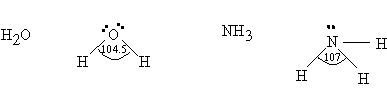 O อะตอมกลางในน้ำ (H2O) มีอิเล็กตรอนคู่โดดเดี่ยวมากกว่า น้ำจึงมีมุมระหว่างพันธะแคบกว่า NH3ซึ่ง N อะตอมกลาง ใน NH3มีอิเล็กตรอนคู่โดดเดี่ยวน้อยกว่า
O อะตอมกลางในน้ำ (H2O) มีอิเล็กตรอนคู่โดดเดี่ยวมากกว่า น้ำจึงมีมุมระหว่างพันธะแคบกว่า NH3ซึ่ง N อะตอมกลาง ใน NH3มีอิเล็กตรอนคู่โดดเดี่ยวน้อยกว่า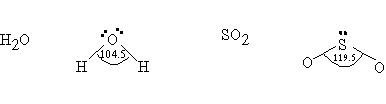 O อะตอมกลางในน้ำ (H2O) มีอิเล็กตรอนคู่โดดเดี่ยวมากกว่า S อะตอมกลางใน SO2ดังนั้น มุมระหว่างพันธะใน H2O แคบกว่า มุมระหว่างพันธะใน SO22. โมเลกุลโคเวเลนต์ใด ๆ ถ้าอะตอมกลางไม่มีอิเล็กตรอน มีแต่อิเล็กตรอนคู่ร่วมพันธะรอบอะตอมกลาง มุมระหว่างพันธะขึ้นกับจำนวนพันธะรอบอะตอมกลาง กล่าวคือ โมเลกุลใดมีจำนวนพันธะมากมุมจะแคบกว่าโมเลกุลที่มีจำนวนพันธะน้อย เช่น
O อะตอมกลางในน้ำ (H2O) มีอิเล็กตรอนคู่โดดเดี่ยวมากกว่า S อะตอมกลางใน SO2ดังนั้น มุมระหว่างพันธะใน H2O แคบกว่า มุมระหว่างพันธะใน SO22. โมเลกุลโคเวเลนต์ใด ๆ ถ้าอะตอมกลางไม่มีอิเล็กตรอน มีแต่อิเล็กตรอนคู่ร่วมพันธะรอบอะตอมกลาง มุมระหว่างพันธะขึ้นกับจำนวนพันธะรอบอะตอมกลาง กล่าวคือ โมเลกุลใดมีจำนวนพันธะมากมุมจะแคบกว่าโมเลกุลที่มีจำนวนพันธะน้อย เช่น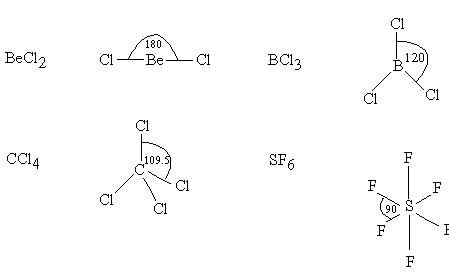 โมเลกุลของสารที่มีอิเล็กตรอนคู่โดดเดี่ยวรอบอะตอมกลาง เรียงลำดับจำนวนพันธะรอบอะตอมกลางจากมากไปน้อย คือ SF6> CCl4> BCl3> BeCl2เรียงลำดับมุมระหว่างพันธะจากน้อยไปมากคือ SF6< CCl4< BCl3< BeCl2อนึ่งโมเลกุลที่มีรูปร่างเป็นพิระมิดคู่ฐานสามเหลี่ยม เช่น PCl5
โมเลกุลของสารที่มีอิเล็กตรอนคู่โดดเดี่ยวรอบอะตอมกลาง เรียงลำดับจำนวนพันธะรอบอะตอมกลางจากมากไปน้อย คือ SF6> CCl4> BCl3> BeCl2เรียงลำดับมุมระหว่างพันธะจากน้อยไปมากคือ SF6< CCl4< BCl3< BeCl2อนึ่งโมเลกุลที่มีรูปร่างเป็นพิระมิดคู่ฐานสามเหลี่ยม เช่น PCl5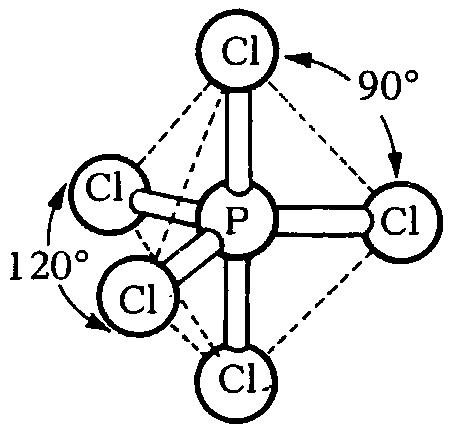 เนื่องจากโมเลกุลที่มีรูปร่าง พิระมิดคู่ฐานสามเหลี่ยมมีค่ามุมหลายค่า คือ มุมระหว่างพันธะที่ฐานเป็น 1200และที่แกนตั้งฉากกับฐานเป็น 900ดังนั้นจึงไม่ควรมาเปรียบเทียบ มุมระหว่างพันธะ กับโมเลกุลโคเวเลนต์อื่น3. โมเลกุลโคเวเลนต์ใด ๆ ที่มีรูปร่างเหมือนกัน แต่เป็นสารต่างชนิดกัน และอะตอมกลางไม่มีอิเล็กตรอนคู่โดดเดี่ยวเหลือ มีพันธะรอบอะตอมกลางในโมเลกุลเดียวกันเหมือนกันหมด โมเลกุลของสารเหล่านั้นจะมีมุมระหว่างพันธะเท่ากันเสมอ เช่น โมเลกุล CH4, CCl4, และ SiCl4
เนื่องจากโมเลกุลที่มีรูปร่าง พิระมิดคู่ฐานสามเหลี่ยมมีค่ามุมหลายค่า คือ มุมระหว่างพันธะที่ฐานเป็น 1200และที่แกนตั้งฉากกับฐานเป็น 900ดังนั้นจึงไม่ควรมาเปรียบเทียบ มุมระหว่างพันธะ กับโมเลกุลโคเวเลนต์อื่น3. โมเลกุลโคเวเลนต์ใด ๆ ที่มีรูปร่างเหมือนกัน แต่เป็นสารต่างชนิดกัน และอะตอมกลางไม่มีอิเล็กตรอนคู่โดดเดี่ยวเหลือ มีพันธะรอบอะตอมกลางในโมเลกุลเดียวกันเหมือนกันหมด โมเลกุลของสารเหล่านั้นจะมีมุมระหว่างพันธะเท่ากันเสมอ เช่น โมเลกุล CH4, CCl4, และ SiCl4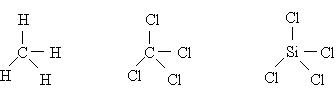 ทุกโมเลกุลมีรูปร่างเป็นทรงสี่หน้าเหมือนกันและอะตอมไม่มีอิเล็กตรอนคู่โดดเดี่ยวเหลือดังนั้น มุมระหว่างพันธะในทุกโมเลกุลจึงกางเท่ากันคือ 109.50โมเลกุลของสารบางชนิด รูปร่างเหมือนกันหมด และอะตอมกลางต่างไม่มีอิเล็กตรอนคู่โดดเดี่ยว แต่พันธะรอบอะตอมกลางในโมเลกุลเดียวกันจะเหมือนกันหรือต่างกันก็ได้ มุมระหว่างพันธะของสารเหล่านั้นเท่ากันเสมอ เช่น โมเลกุลของสารที่มีรูปร่างเป็น เส้นตรง ได้แก่ โมเลกุลของ BeCl2, HCN , CO2, Cl - Be - Cl , H - C N , O = C = O4. โมเลกุลโคเวเลนต์ที่มีรูปร่างเหมือนกัน แต่สารต่างชนิดกัน และอะตอมกลางต่างเหลืออิเล็กตรอนคู่โดดเดี่ยวเท่ากัน โมเลกุลของสารเหล่านั้นจะมีมุมระหว่างพันธะต่างกันเสมอ แต่มุมระหว่างพันธะในแต่ละโมเลกุลจะกางเท่าไรนั้นขึ้นอยู่กับอิเล็กตรอนคู่ร่วมพันธะว่าอยู่ห่างจากอะตอมกลางแค่ไหน ถ้าใกล้อะตอมกลางจะผลักกันมากต้านไม่ให้อิเล็กตรอนคู่โดดเดี่ยวผลักลงได้มาก ทำให้มุมกว้างกว่า แต่ถ้าไกลอะตอมกลางมากจะผลักกันน้อย จึงต้านแรงผลักลงของอิเล็กตรอนคู่โดดเดี่ยวได้น้อย ทำให้มุมแคบลง อย่างไรก็ตามการพิจารณาว่าอิเล็กตรอนคู่ร่วมพันธะอยู่ใกล้ไกลอะตอมกลางแค่ไหนนั้นจำเป็นต้องใช้ค่าอิเล็กโตรเนกาติวิตีของธาตุเป็นเกณฑ์ เช่นพิจารณาโมเลกุล H2S และ H2O ซึ่งต่างก็มีรูปร่างเหมือนกัน คือเป็นมุมงอ แต่เนื่องจากอะตอมกลางมีอิเล็กตรอนคู่โดดเดี่ยวเหลือ มุมระหว่างพันธะของโมเลกุลของสารทั้งสองเป็นดังนี้
ทุกโมเลกุลมีรูปร่างเป็นทรงสี่หน้าเหมือนกันและอะตอมไม่มีอิเล็กตรอนคู่โดดเดี่ยวเหลือดังนั้น มุมระหว่างพันธะในทุกโมเลกุลจึงกางเท่ากันคือ 109.50โมเลกุลของสารบางชนิด รูปร่างเหมือนกันหมด และอะตอมกลางต่างไม่มีอิเล็กตรอนคู่โดดเดี่ยว แต่พันธะรอบอะตอมกลางในโมเลกุลเดียวกันจะเหมือนกันหรือต่างกันก็ได้ มุมระหว่างพันธะของสารเหล่านั้นเท่ากันเสมอ เช่น โมเลกุลของสารที่มีรูปร่างเป็น เส้นตรง ได้แก่ โมเลกุลของ BeCl2, HCN , CO2, Cl - Be - Cl , H - C N , O = C = O4. โมเลกุลโคเวเลนต์ที่มีรูปร่างเหมือนกัน แต่สารต่างชนิดกัน และอะตอมกลางต่างเหลืออิเล็กตรอนคู่โดดเดี่ยวเท่ากัน โมเลกุลของสารเหล่านั้นจะมีมุมระหว่างพันธะต่างกันเสมอ แต่มุมระหว่างพันธะในแต่ละโมเลกุลจะกางเท่าไรนั้นขึ้นอยู่กับอิเล็กตรอนคู่ร่วมพันธะว่าอยู่ห่างจากอะตอมกลางแค่ไหน ถ้าใกล้อะตอมกลางจะผลักกันมากต้านไม่ให้อิเล็กตรอนคู่โดดเดี่ยวผลักลงได้มาก ทำให้มุมกว้างกว่า แต่ถ้าไกลอะตอมกลางมากจะผลักกันน้อย จึงต้านแรงผลักลงของอิเล็กตรอนคู่โดดเดี่ยวได้น้อย ทำให้มุมแคบลง อย่างไรก็ตามการพิจารณาว่าอิเล็กตรอนคู่ร่วมพันธะอยู่ใกล้ไกลอะตอมกลางแค่ไหนนั้นจำเป็นต้องใช้ค่าอิเล็กโตรเนกาติวิตีของธาตุเป็นเกณฑ์ เช่นพิจารณาโมเลกุล H2S และ H2O ซึ่งต่างก็มีรูปร่างเหมือนกัน คือเป็นมุมงอ แต่เนื่องจากอะตอมกลางมีอิเล็กตรอนคู่โดดเดี่ยวเหลือ มุมระหว่างพันธะของโมเลกุลของสารทั้งสองเป็นดังนี้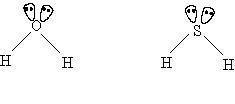 มุมH - O - H กาง 1050มุม H - S -H กาง 93.30จะเห็นได้ว่ามุม H - O - H ของ H2O กางกว้างกว่ามุม H - S -H ของ H2S เพราะขนาดอะตอม S และ O ต่างกัน และความแตกต่างระหว่างค่าอิเล็กโตรเนกาติวิตีของ O กับ H มากกว่า S กับ H ทำให้กลุ่มหมอกอิเล็กตรอนคู่ร่วมพันธะในโมเลกุลของ H2O อยู่ใกล้ O ซึ่งเป็นอะตอมกลาง จึงออกแรงผลักกันมากกว่าอิเล็กตรอนคู่ร่วมพันธะในโมเลกุลของ H2S ดังนั้นมุมระหว่างพันธะใน H2O จึงมีขนาดใหญ่กว่ามุมใน H2Sพิจารณาโมเลกุล NH3และ NF3ซึ่งต่างก็มีรูปร่างเหมือนกัน คือเป็น พีระมิดฐานสามเหลี่ยมแต่เนื่องจากอะตอมกลางมีอิเล็กตรอนคู่โดดเดี่ยวเหลือ มุมระหว่างพันธะของโมเลกุลของสารทั้งสองเป็นดังนี้
มุมH - O - H กาง 1050มุม H - S -H กาง 93.30จะเห็นได้ว่ามุม H - O - H ของ H2O กางกว้างกว่ามุม H - S -H ของ H2S เพราะขนาดอะตอม S และ O ต่างกัน และความแตกต่างระหว่างค่าอิเล็กโตรเนกาติวิตีของ O กับ H มากกว่า S กับ H ทำให้กลุ่มหมอกอิเล็กตรอนคู่ร่วมพันธะในโมเลกุลของ H2O อยู่ใกล้ O ซึ่งเป็นอะตอมกลาง จึงออกแรงผลักกันมากกว่าอิเล็กตรอนคู่ร่วมพันธะในโมเลกุลของ H2S ดังนั้นมุมระหว่างพันธะใน H2O จึงมีขนาดใหญ่กว่ามุมใน H2Sพิจารณาโมเลกุล NH3และ NF3ซึ่งต่างก็มีรูปร่างเหมือนกัน คือเป็น พีระมิดฐานสามเหลี่ยมแต่เนื่องจากอะตอมกลางมีอิเล็กตรอนคู่โดดเดี่ยวเหลือ มุมระหว่างพันธะของโมเลกุลของสารทั้งสองเป็นดังนี้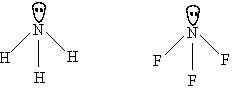 มุม H - N - H กาง 1070มุม F - N - F กาง 1020จะเห็นได้ว่ามุม H - N - H ของ NH3กางกว้างกว่ามุม F - N - F ของ NF3เพราะ F ในโมเลกุล NF3ซึ่งมีค่าอิเล็กโตรเนกาติวิตีสูงที่สุด ซึ่งจะดึงดูดอิเล็กตรอนคู่ร่วมพันธะได้มาก ทำให้กลุ่มหมอกอิเล็กตรอนคู่ร่วมพันธะในโมเลกุลของ NF3อยู่ใกล้ F จึงเกิดแรงผลักน้อย ส่วน NH3มี N เป็นอะตอมกลางมีค่าอิเล็กโตรเนกาติวิตีสูงกว่า H จึงดึงดูดกลุ่มหมอกอิเล็กตรอนคู่ร่วมพันธะในโมเลกุล NH3เข้ามาใกล้ N ทำให้เกิดแรงผลักมาก ดังนั้นมุมระหว่างพันธะใน NH3จึงมีขนาดใหญ่กว่ามุมใน NF3สรุปโมเลกุลโคเวเลนต์ที่มีรูปร่างเหมือนกัน และอะตอมกลางมีอิเล็กตรอนคู่โดดเดี่ยวเท่ากัน จะมีมุมระหว่างพันธะต่างกัน พิจารณาได้ดังนี้มุมระหว่างพันธะพิจารณาที่ระยะห่างของอิเล็กตรอนคู่ร่วมพันธะเป็นเกณฑ์ กล่าวคือ ถ้าอิเล็กตรอนคู่ร่วมพันธะอยู่ห่างอะตอมมากมุมแคบ และอิเล็กตรอนคู่ร่วมพันธะอยู่ใกล้อะตอมกลางมุมกว้างมุมระหว่างพันธะเปลี่ยนแปลงตามค่า EN ของอะตอมกลางของธาตุที่ต่างกัน แต่ละอะตอมที่ล้อมรอบอะตอมกลางเหมือนกันมุมระหว่างพันธะเปลี่ยนกลับกับค่า EN ของอะตอมที่ล้อมรอบอะตอมกลางที่ต่างกัน แต่อะตอมกลางเหมือนกัน
มุม H - N - H กาง 1070มุม F - N - F กาง 1020จะเห็นได้ว่ามุม H - N - H ของ NH3กางกว้างกว่ามุม F - N - F ของ NF3เพราะ F ในโมเลกุล NF3ซึ่งมีค่าอิเล็กโตรเนกาติวิตีสูงที่สุด ซึ่งจะดึงดูดอิเล็กตรอนคู่ร่วมพันธะได้มาก ทำให้กลุ่มหมอกอิเล็กตรอนคู่ร่วมพันธะในโมเลกุลของ NF3อยู่ใกล้ F จึงเกิดแรงผลักน้อย ส่วน NH3มี N เป็นอะตอมกลางมีค่าอิเล็กโตรเนกาติวิตีสูงกว่า H จึงดึงดูดกลุ่มหมอกอิเล็กตรอนคู่ร่วมพันธะในโมเลกุล NH3เข้ามาใกล้ N ทำให้เกิดแรงผลักมาก ดังนั้นมุมระหว่างพันธะใน NH3จึงมีขนาดใหญ่กว่ามุมใน NF3สรุปโมเลกุลโคเวเลนต์ที่มีรูปร่างเหมือนกัน และอะตอมกลางมีอิเล็กตรอนคู่โดดเดี่ยวเท่ากัน จะมีมุมระหว่างพันธะต่างกัน พิจารณาได้ดังนี้มุมระหว่างพันธะพิจารณาที่ระยะห่างของอิเล็กตรอนคู่ร่วมพันธะเป็นเกณฑ์ กล่าวคือ ถ้าอิเล็กตรอนคู่ร่วมพันธะอยู่ห่างอะตอมมากมุมแคบ และอิเล็กตรอนคู่ร่วมพันธะอยู่ใกล้อะตอมกลางมุมกว้างมุมระหว่างพันธะเปลี่ยนแปลงตามค่า EN ของอะตอมกลางของธาตุที่ต่างกัน แต่ละอะตอมที่ล้อมรอบอะตอมกลางเหมือนกันมุมระหว่างพันธะเปลี่ยนกลับกับค่า EN ของอะตอมที่ล้อมรอบอะตอมกลางที่ต่างกัน แต่อะตอมกลางเหมือนกัน

ไม่มีความคิดเห็น:
แสดงความคิดเห็น